+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 4wzv | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of a hydroxamate based inhibitor EN140 in complex with the MMP-9 catalytic domain | ||||||
 要素 要素 | Matrix metalloproteinase-9,Matrix metalloproteinase-9 | ||||||
 キーワード キーワード | HYDROLASE / MMP9 Inhibitor complex / Thyroid hormone-binding protein | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報gelatinase B / negative regulation of epithelial cell differentiation involved in kidney development / : / : / cellular response to UV-A / regulation of neuroinflammatory response / positive regulation of keratinocyte migration / Assembly of collagen fibrils and other multimeric structures / positive regulation of DNA binding / positive regulation of epidermal growth factor receptor signaling pathway ...gelatinase B / negative regulation of epithelial cell differentiation involved in kidney development / : / : / cellular response to UV-A / regulation of neuroinflammatory response / positive regulation of keratinocyte migration / Assembly of collagen fibrils and other multimeric structures / positive regulation of DNA binding / positive regulation of epidermal growth factor receptor signaling pathway / Activation of Matrix Metalloproteinases / negative regulation of intrinsic apoptotic signaling pathway / positive regulation of release of cytochrome c from mitochondria / endodermal cell differentiation / response to amyloid-beta / Collagen degradation / collagen catabolic process / macrophage differentiation / extracellular matrix disassembly / EPH-ephrin mediated repulsion of cells / ephrin receptor signaling pathway / collagen binding / positive regulation of vascular associated smooth muscle cell proliferation / Degradation of the extracellular matrix / extracellular matrix organization / embryo implantation / skeletal system development / Signaling by SCF-KIT / metalloendopeptidase activity / positive regulation of protein phosphorylation / metallopeptidase activity / tertiary granule lumen / cell migration / peptidase activity / : / cellular response to lipopolysaccharide / Interleukin-4 and Interleukin-13 signaling / endopeptidase activity / ficolin-1-rich granule lumen / Extra-nuclear estrogen signaling / positive regulation of apoptotic process / serine-type endopeptidase activity / apoptotic process / Neutrophil degranulation / negative regulation of apoptotic process / proteolysis / extracellular space / extracellular exosome / extracellular region / zinc ion binding / identical protein binding 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.65 Å 分子置換 / 解像度: 1.65 Å | ||||||
 データ登録者 データ登録者 | Stura, E.A. / Vera, L. / Cassar-Lajeunesse, E. / Nuti, E. / Dive, V. / Rossello, A. | ||||||
 引用 引用 |  ジャーナル: J.Med.Chem. / 年: 2015 ジャーナル: J.Med.Chem. / 年: 2015タイトル: N-O-Isopropyl Sulfonamido-Based Hydroxamates as Matrix Metalloproteinase Inhibitors: Hit Selection and in Vivo Antiangiogenic Activity. 著者: Nuti, E. / Cantelmo, A.R. / Gallo, C. / Bruno, A. / Bassani, B. / Camodeca, C. / Tuccinardi, T. / Vera, L. / Orlandini, E. / Nencetti, S. / Stura, E.A. / Martinelli, A. / Dive, V. / Albini, A. / Rossello, A. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4wzv.cif.gz 4wzv.cif.gz | 106 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4wzv.ent.gz pdb4wzv.ent.gz | 78.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4wzv.json.gz 4wzv.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  4wzv_validation.pdf.gz 4wzv_validation.pdf.gz | 1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  4wzv_full_validation.pdf.gz 4wzv_full_validation.pdf.gz | 1 MB | 表示 | |
| XML形式データ |  4wzv_validation.xml.gz 4wzv_validation.xml.gz | 23.9 KB | 表示 | |
| CIF形式データ |  4wzv_validation.cif.gz 4wzv_validation.cif.gz | 36.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/wz/4wzv https://data.pdbj.org/pub/pdb/validation_reports/wz/4wzv ftp://data.pdbj.org/pub/pdb/validation_reports/wz/4wzv ftp://data.pdbj.org/pub/pdb/validation_reports/wz/4wzv | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 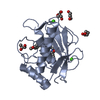
| ||||||||
| 2 | 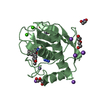
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 2分子 AB
| #1: タンパク質 | 分子量: 17904.859 Da / 分子数: 2 断片: catalytic domain, UNP residues 110-216,catalytic domain, UNP residues 392-444 由来タイプ: 組換発現 詳細: E40 is a ligand. 7 residues have been cleaved. unp residues 110-214 and 391-444 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: MMP9, CLG4B / 発現宿主: Homo sapiens (ヒト) / 遺伝子: MMP9, CLG4B / 発現宿主:  |
|---|
-非ポリマー , 10種, 659分子 

















| #2: 化合物 | | #3: 化合物 | ChemComp-ZN / #4: 化合物 | ChemComp-CA / #5: 化合物 | #6: 化合物 | #7: 化合物 | ChemComp-PEG / #8: 化合物 | ChemComp-AZI / | #9: 化合物 | ChemComp-NA / #10: 化合物 | ChemComp-GOL / | #11: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.29 Å3/Da / 溶媒含有率: 46.31 % / 解説: long prismatic crystals |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 7.25 詳細: protein: 5mg/mL hMMP9-WT with 120 milli-M acetohydroxamic acid. Reservoir: 36% MPEG 5K, 90mM bicine, pH 7.25. Cryoprotectant: 40% MPEG 5K, 5% Di-ethyleneglycol, 10% AAB buffer, pH 8.0 PH範囲: 7.25-8.0 / Temp details: cooled incubator |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: ID14-1 / 波長: 0.933 Å / ビームライン: ID14-1 / 波長: 0.933 Å |
| 検出器 | タイプ: ADSC QUANTUM 4r / 検出器: CCD / 日付: 2010年11月24日 / 詳細: mirrors |
| 放射 | モノクロメーター: Si 111 CHANNEL / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.933 Å / 相対比: 1 |
| 反射 | 解像度: 1.65→50 Å / Num. all: 38771 / Num. obs: 38365 / % possible obs: 99 % / 冗長度: 4.17 % / Biso Wilson estimate: 21.971 Å2 / Rmerge(I) obs: 0.166 / Rsym value: 0.144 / Net I/σ(I): 8.41 |
| 反射 シェル | 解像度: 1.65→1.75 Å / 冗長度: 3.92 % / Rmerge(I) obs: 1.339 / Mean I/σ(I) obs: 1.19 / % possible all: 94.9 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 4H3X 解像度: 1.65→42.126 Å / SU ML: 0.16 / 交差検証法: THROUGHOUT / σ(F): 0 / 位相誤差: 20.61 / 立体化学のターゲット値: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.65→42.126 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
|
 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj



















