[English] 日本語
 Yorodumi
Yorodumi- PDB-4r6e: Human artd1 (parp1) - catalytic domain in complex with inhibitor ... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 4r6e | ||||||
|---|---|---|---|---|---|---|---|
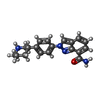
| Title | Human artd1 (parp1) - catalytic domain in complex with inhibitor niraparib | ||||||
 Components Components | Poly [ADP-ribose] polymerase 1 | ||||||
 Keywords Keywords | TRANSFERASE/TRANSFERASE INHIBITOR / ADP-RIBOSYLATION / DNA REPAIR / ADP-RIBOSYL TRANSFERASE / TRANSFERASE-TRANSFERASE INHIBITOR complex | ||||||
| Function / homology |  Function and homology information Function and homology informationNAD+-histone H2BS6 serine ADP-ribosyltransferase activity / NAD+-histone H3S10 serine ADP-ribosyltransferase activity / NAD+-histone H2BE35 glutamate ADP-ribosyltransferase activity / positive regulation of myofibroblast differentiation / negative regulation of ATP biosynthetic process / NAD+-protein-tyrosine ADP-ribosyltransferase activity / NAD+-protein-histidine ADP-ribosyltransferase activity / regulation of base-excision repair / positive regulation of single strand break repair / regulation of circadian sleep/wake cycle, non-REM sleep ...NAD+-histone H2BS6 serine ADP-ribosyltransferase activity / NAD+-histone H3S10 serine ADP-ribosyltransferase activity / NAD+-histone H2BE35 glutamate ADP-ribosyltransferase activity / positive regulation of myofibroblast differentiation / negative regulation of ATP biosynthetic process / NAD+-protein-tyrosine ADP-ribosyltransferase activity / NAD+-protein-histidine ADP-ribosyltransferase activity / regulation of base-excision repair / positive regulation of single strand break repair / regulation of circadian sleep/wake cycle, non-REM sleep / mitochondrial DNA metabolic process / vRNA Synthesis / carbohydrate biosynthetic process / NAD+-protein-serine ADP-ribosyltransferase activity / negative regulation of adipose tissue development / NAD DNA ADP-ribosyltransferase activity / DNA ADP-ribosylation / regulation of oxidative stress-induced neuron intrinsic apoptotic signaling pathway / replication fork reversal / ATP generation from poly-ADP-D-ribose / positive regulation of necroptotic process / transcription regulator activator activity / response to aldosterone / HDR through MMEJ (alt-NHEJ) / positive regulation of DNA-templated transcription, elongation / NAD+ ADP-ribosyltransferase / signal transduction involved in regulation of gene expression / protein auto-ADP-ribosylation / negative regulation of telomere maintenance via telomere lengthening / mitochondrial DNA repair / NAD+-protein-aspartate ADP-ribosyltransferase activity / protein poly-ADP-ribosylation / positive regulation of intracellular estrogen receptor signaling pathway / negative regulation of cGAS/STING signaling pathway / NAD+-protein-glutamate ADP-ribosyltransferase activity / positive regulation of cardiac muscle hypertrophy / NAD+-protein mono-ADP-ribosyltransferase activity / cellular response to zinc ion / positive regulation of mitochondrial depolarization / nuclear replication fork / decidualization / protein autoprocessing / R-SMAD binding / macrophage differentiation / Transferases; Glycosyltransferases; Pentosyltransferases / negative regulation of transcription elongation by RNA polymerase II / positive regulation of SMAD protein signal transduction / POLB-Dependent Long Patch Base Excision Repair / NAD+ poly-ADP-ribosyltransferase activity / site of DNA damage / SUMOylation of DNA damage response and repair proteins / nucleosome binding / positive regulation of double-strand break repair via homologous recombination / protein localization to chromatin / nucleotidyltransferase activity / transforming growth factor beta receptor signaling pathway / negative regulation of innate immune response / telomere maintenance / nuclear estrogen receptor binding / response to gamma radiation / mitochondrion organization / protein modification process / Downregulation of SMAD2/3:SMAD4 transcriptional activity / enzyme activator activity / protein-DNA complex / cellular response to nerve growth factor stimulus / positive regulation of protein localization to nucleus / DNA Damage Recognition in GG-NER / Dual Incision in GG-NER / cellular response to insulin stimulus / cellular response to amyloid-beta / histone deacetylase binding / NAD binding / Formation of Incision Complex in GG-NER / cellular response to UV / nuclear envelope / double-strand break repair / regulation of protein localization / site of double-strand break / cellular response to oxidative stress / transcription regulator complex / transcription by RNA polymerase II / damaged DNA binding / RNA polymerase II-specific DNA-binding transcription factor binding / chromosome, telomeric region / positive regulation of canonical NF-kappaB signal transduction / nuclear body / innate immune response / DNA repair / negative regulation of DNA-templated transcription / apoptotic process / DNA damage response / ubiquitin protein ligase binding / chromatin binding / protein kinase binding / chromatin / nucleolus / enzyme binding / negative regulation of transcription by RNA polymerase II / protein homodimerization activity Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.2 Å MOLECULAR REPLACEMENT / Resolution: 2.2 Å | ||||||
 Authors Authors | Karlberg, T. / Thorsell, A.G. / Brock, J. / Schuler, H. | ||||||
 Citation Citation |  Journal: J.Med.Chem. / Year: 2017 Journal: J.Med.Chem. / Year: 2017Title: Structural Basis for Potency and Promiscuity in Poly(ADP-ribose) Polymerase (PARP) and Tankyrase Inhibitors. Authors: Thorsell, A.G. / Ekblad, T. / Karlberg, T. / Low, M. / Pinto, A.F. / Tresaugues, L. / Moche, M. / Cohen, M.S. / Schuler, H. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  4r6e.cif.gz 4r6e.cif.gz | 559.9 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb4r6e.ent.gz pdb4r6e.ent.gz | 467.6 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  4r6e.json.gz 4r6e.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/r6/4r6e https://data.pdbj.org/pub/pdb/validation_reports/r6/4r6e ftp://data.pdbj.org/pub/pdb/validation_reports/r6/4r6e ftp://data.pdbj.org/pub/pdb/validation_reports/r6/4r6e | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  4r5wC  4rv6C  4tvjC  4undC  4uxbC  5lx6C  4gv7S C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| Unit cell |
|
- Components
Components
| #1: Protein | Mass: 40199.949 Da / Num. of mol.: 4 / Fragment: CATALYTIC DOMAIN (UNP residues 662-1011) Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: ADPRT, PARP1, PPOL / Plasmid: pNIC-CH / Production host: Homo sapiens (human) / Gene: ADPRT, PARP1, PPOL / Plasmid: pNIC-CH / Production host:  #2: Chemical | ChemComp-3JD / #3: Chemical | ChemComp-SO4 / #4: Chemical | #5: Water | ChemComp-HOH / | Has protein modification | Y | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.51 Å3/Da / Density % sol: 50.94 % |
|---|---|
| Crystal grow | Temperature: 277 K / Method: vapor diffusion, sitting drop / pH: 5.5 Details: 20% PEG-3350, 0.16M Ammonium Sulfate, 0.08M Bis-Tris, 0.001M Niraparib, pH 5.5, VAPOR DIFFUSION, SITTING DROP, temperature 277K |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  Diamond Diamond  / Beamline: I03 / Wavelength: 0.9763 Å / Beamline: I03 / Wavelength: 0.9763 Å |
| Detector | Type: PSI PILATUS 6M / Detector: PIXEL / Date: Jun 30, 2014 / Details: mirrors |
| Radiation | Monochromator: Double crystal monochromator / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.9763 Å / Relative weight: 1 |
| Reflection | Resolution: 2.2→86.32 Å / Num. all: 82734 / Num. obs: 82734 / % possible obs: 100 % / Observed criterion σ(F): 0 / Observed criterion σ(I): 0 / Redundancy: 13.2 % / Biso Wilson estimate: 45.1 Å2 / Rmerge(I) obs: 0.087 / Net I/σ(I): 18.4 |
| Reflection shell | Resolution: 2.2→2.26 Å / Redundancy: 13.7 % / Rmerge(I) obs: 0.722 / Mean I/σ(I) obs: 4 / Num. unique all: 6064 / % possible all: 100 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB ENTRY 4GV7 Resolution: 2.2→86.3 Å / Cor.coef. Fo:Fc: 0.9437 / Cor.coef. Fo:Fc free: 0.9305 / SU R Cruickshank DPI: 0.243 / Cross valid method: THROUGHOUT / σ(F): 0 / σ(I): 0 / Stereochemistry target values: Engh & Huber
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 58.05 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.359 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.2→86.3 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.2→2.26 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller












 PDBj
PDBj