| Entry | Database: PDB / ID: 4qra
|
|---|
| Title | Structure and specificity of L-D-Transpeptidase from Mycobacterium tuberculosis and antibiotic resistance: Calcium binding promotes dimer formation |
|---|
 Components Components | L,d-transpeptidase LdtB |
|---|
 Keywords Keywords | HYDROLASE / Structural Genomics / Enzyme Function Initiative / Center for Structural Genomics of Infectious Diseases / CSGID / L-D-transpeptidase / D-D-transpeptidase / Single anomalous diffraction / imipenem / meropenem |
|---|
| Function / homology |  Function and homology information Function and homology information
peptidoglycan-protein cross-linking / peptidoglycan L,D-transpeptidase activity / Transferases; Acyltransferases; Aminoacyltransferases / acyltransferase activity / cell wall organization / regulation of cell shape / metal ion binding / plasma membraneSimilarity search - Function Immunoglobulin-like - #3710 / Bacterial Ig domain, transpeptidase-associated / Bacterial Ig domain / L,D-transpeptidase catalytic domain-like / L,D-transpeptidase catalytic domain-like / : / L,D-transpeptidase (L,D-TPase) catalytic domain profile. / L,D-transpeptidase catalytic domain / L,D-transpeptidase catalytic domain-like / L,D-transpeptidase catalytic domain ...Immunoglobulin-like - #3710 / Bacterial Ig domain, transpeptidase-associated / Bacterial Ig domain / L,D-transpeptidase catalytic domain-like / L,D-transpeptidase catalytic domain-like / : / L,D-transpeptidase (L,D-TPase) catalytic domain profile. / L,D-transpeptidase catalytic domain / L,D-transpeptidase catalytic domain-like / L,D-transpeptidase catalytic domain / Prokaryotic membrane lipoprotein lipid attachment site profile. / Beta Barrel / Immunoglobulin-like / Sandwich / Mainly BetaSimilarity search - Domain/homology |
|---|
| Biological species |   Mycobacterium tuberculosis (bacteria) Mycobacterium tuberculosis (bacteria) |
|---|
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.29 Å MOLECULAR REPLACEMENT / Resolution: 2.29 Å |
|---|
 Authors Authors | Gokulan, K. / Varughese, K.I. |
|---|
 Citation Citation |  Journal: To be Published Journal: To be Published
Title: Structure and specificity of L-D-Transpeptidase from Mycobacterium tuberculosis and antibiotic resistance: Calcium binding promotes dimer formation
Authors: Gokulan, K. / Khare, S. / Cerniglia, C.E. / Foley, S.L. / Varughese, K.I. |
|---|
| History | | Deposition | Jun 30, 2014 | Deposition site: RCSB / Processing site: RCSB |
|---|
| Revision 1.0 | Dec 23, 2015 | Provider: repository / Type: Initial release |
|---|
| Revision 1.1 | Aug 24, 2016 | Group: Structure summary |
|---|
| Revision 1.2 | Feb 28, 2024 | Group: Data collection / Database references / Derived calculations
Category: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_struct_conn_angle / struct_conn / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_asym_id / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 Yorodumi
Yorodumi Open data
Open data Basic information
Basic information Components
Components Keywords
Keywords Function and homology information
Function and homology information
 X-RAY DIFFRACTION /
X-RAY DIFFRACTION /  SYNCHROTRON /
SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.29 Å
MOLECULAR REPLACEMENT / Resolution: 2.29 Å  Authors
Authors Citation
Citation Journal: To be Published
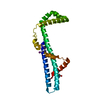
Journal: To be Published Structure visualization
Structure visualization Molmil
Molmil Jmol/JSmol
Jmol/JSmol Downloads & links
Downloads & links Download
Download 4qra.cif.gz
4qra.cif.gz PDBx/mmCIF format
PDBx/mmCIF format pdb4qra.ent.gz
pdb4qra.ent.gz PDB format
PDB format 4qra.json.gz
4qra.json.gz PDBx/mmJSON format
PDBx/mmJSON format Other downloads
Other downloads https://data.pdbj.org/pub/pdb/validation_reports/qr/4qra
https://data.pdbj.org/pub/pdb/validation_reports/qr/4qra ftp://data.pdbj.org/pub/pdb/validation_reports/qr/4qra
ftp://data.pdbj.org/pub/pdb/validation_reports/qr/4qra Links
Links Assembly
Assembly


 Components
Components

 X-RAY DIFFRACTION / Number of used crystals: 1
X-RAY DIFFRACTION / Number of used crystals: 1  Sample preparation
Sample preparation SYNCHROTRON / Site:
SYNCHROTRON / Site:  SSRL
SSRL  / Beamline: BL9-2
/ Beamline: BL9-2 Processing
Processing MOLECULAR REPLACEMENT / Resolution: 2.29→34.86 Å / Cor.coef. Fo:Fc: 0.948 / Cor.coef. Fo:Fc free: 0.926 / SU B: 9.388 / SU ML: 0.122 / Cross valid method: THROUGHOUT / ESU R: 0.248 / ESU R Free: 0.201 / Stereochemistry target values: MAXIMUM LIKELIHOOD / Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
MOLECULAR REPLACEMENT / Resolution: 2.29→34.86 Å / Cor.coef. Fo:Fc: 0.948 / Cor.coef. Fo:Fc free: 0.926 / SU B: 9.388 / SU ML: 0.122 / Cross valid method: THROUGHOUT / ESU R: 0.248 / ESU R Free: 0.201 / Stereochemistry target values: MAXIMUM LIKELIHOOD / Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS Movie
Movie Controller
Controller














 PDBj
PDBj






