+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 4mvt | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of SUMO E3 Ligase PIAS3 | ||||||
 要素 要素 | E3 SUMO-protein ligase PIAS3 | ||||||
 キーワード キーワード | LIGASE / SUMO / E3 Ligase / PINIT domain / SP-RING domain / Structural Genomics / Structural Genomics Consortium / SGC | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報SUMO ligase activity / positive regulation of protein sumoylation / SUMOylation of immune response proteins / negative regulation of protein sumoylation / regulation of tumor necrosis factor-mediated signaling pathway / 転移酵素; アシル基を移すもの; アミノアシル基を移すもの / SUMO transferase activity / negative regulation of osteoclast differentiation / SUMOylation of transcription factors / SUMOylation of DNA replication proteins ...SUMO ligase activity / positive regulation of protein sumoylation / SUMOylation of immune response proteins / negative regulation of protein sumoylation / regulation of tumor necrosis factor-mediated signaling pathway / 転移酵素; アシル基を移すもの; アミノアシル基を移すもの / SUMO transferase activity / negative regulation of osteoclast differentiation / SUMOylation of transcription factors / SUMOylation of DNA replication proteins / protein sumoylation / postsynaptic cytosol / presynaptic cytosol / SUMOylation of transcription cofactors / transcription coregulator activity / SUMOylation of intracellular receptors / Formation of Incision Complex in GG-NER / nuclear speck / negative regulation of gene expression / regulation of transcription by RNA polymerase II / chromatin / glutamatergic synapse / negative regulation of transcription by RNA polymerase II / zinc ion binding / nucleoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.3 Å 分子置換 / 解像度: 2.3 Å | ||||||
 データ登録者 データ登録者 | Dong, A. / Hu, J. / Li, Y. / Tempel, W. / Bountra, C. / Arrowsmith, C.H. / Edwards, A.M. / Tong, Y. / Structural Genomics Consortium (SGC) | ||||||
 引用 引用 |  ジャーナル: to be published ジャーナル: to be publishedタイトル: Crystal structure of SUMO E3 Ligase PIAS3 著者: Hu, J. / Dong, a. / Li, Y. / Tempel, W. / Bountra, C. / Arrowsmith, C.H. / Edwards, A.M. / Tong, Y. / Structural Genomics Consortium (SGC) | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4mvt.cif.gz 4mvt.cif.gz | 403 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4mvt.ent.gz pdb4mvt.ent.gz | 328.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4mvt.json.gz 4mvt.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  4mvt_validation.pdf.gz 4mvt_validation.pdf.gz | 469.5 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  4mvt_full_validation.pdf.gz 4mvt_full_validation.pdf.gz | 474.7 KB | 表示 | |
| XML形式データ |  4mvt_validation.xml.gz 4mvt_validation.xml.gz | 35.6 KB | 表示 | |
| CIF形式データ |  4mvt_validation.cif.gz 4mvt_validation.cif.gz | 49.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/mv/4mvt https://data.pdbj.org/pub/pdb/validation_reports/mv/4mvt ftp://data.pdbj.org/pub/pdb/validation_reports/mv/4mvt ftp://data.pdbj.org/pub/pdb/validation_reports/mv/4mvt | HTTPS FTP |
-関連構造データ
| 関連構造データ |  4fo9S S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 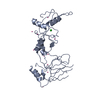
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 単位格子 |
| ||||||||
| 詳細 | AS PER THE AUTHORS THE BIOLOGICAL ASSEMBLY IS UNKNOWN |
- 要素
要素
| #1: タンパク質 | 分子量: 41928.980 Da / 分子数: 4 / 断片: UNP residues 112-467 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PIAS3 / プラスミド: pET28-MHL / 発現宿主: Homo sapiens (ヒト) / 遺伝子: PIAS3 / プラスミド: pET28-MHL / 発現宿主:  参照: UniProt: Q9Y6X2, 合成酵素; C-N結合を形成; 酸-D-アミノ酸リガーゼ(ペプチド合成) #2: 化合物 | ChemComp-ZN / #3: 化合物 | #4: 化合物 | ChemComp-UNX / #5: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.5 Å3/Da / 溶媒含有率: 50.83 % |
|---|---|
| 結晶化 | 温度: 291 K / pH: 8.5 詳細: 20% PEG 8000, 0.2 M Magnesium Chloride, 0.1 M Tris pH8.5,(1:800-1:1300) w/w chymotrypsin, vapor diffusion hanging drop, temperature 291K |
-データ収集
| 回折 | 平均測定温度: 100 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  APS APS  / ビームライン: 19-ID / 波長: 0.97918 Å / ビームライン: 19-ID / 波長: 0.97918 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: ADSC QUANTUM 315r / 検出器: CCD / 日付: 2013年8月15日 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長: 0.97918 Å / 相対比: 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 2.3→50 Å / Num. obs: 71156 / % possible obs: 98.4 % / 冗長度: 5.1 % / Biso Wilson estimate: 47.58 Å2 / Rmerge(I) obs: 0.137 / Χ2: 1.635 / Net I/σ(I): 18.1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル |
|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB entry 4FO9 解像度: 2.3→48.04 Å / Cor.coef. Fo:Fc: 0.9137 / Cor.coef. Fo:Fc free: 0.8947 / Occupancy max: 1 / Occupancy min: 0.5 / SU R Cruickshank DPI: 0.244 / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: Engh & Huber 詳細: AUTHOR NOTE UNEXPLAINED DENSITY AT L341 IN CHAIN A AND B THE ELECTRON DENSITY FOR RESIDUES 316 TO 319 IN ALL CHAINS ARE WITH VERY POOR QUALITY. THE RESIDUES 316 TO 319 IN CHAIN A AND C ARE ...詳細: AUTHOR NOTE UNEXPLAINED DENSITY AT L341 IN CHAIN A AND B THE ELECTRON DENSITY FOR RESIDUES 316 TO 319 IN ALL CHAINS ARE WITH VERY POOR QUALITY. THE RESIDUES 316 TO 319 IN CHAIN A AND C ARE MODELED BUT WITH QUESTIONS.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 300 Å2 / Biso mean: 48.5626 Å2 / Biso min: 14.1 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.398 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.3→48.04 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.3→2.35 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj
















