[English] 日本語
 Yorodumi
Yorodumi- PDB-4mvk: Crystal structure of an engineered lipocalin (Anticalin US7) in c... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 4mvk | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal structure of an engineered lipocalin (Anticalin US7) in complex with the Alzheimer amyloid peptide fragment VFFAED | ||||||
 Components Components |
| ||||||
 Keywords Keywords | PROTEIN BINDING/PROTEIN FIBRIL / beta-barrel / engineered lipocalin / binding protein / PROTEIN BINDING-PROTEIN FIBRIL complex | ||||||
| Function / homology |  Function and homology information Function and homology informationpositive regulation of hippocampal neuron apoptotic process / positive regulation of iron ion import across plasma membrane / positive regulation of endothelial tube morphogenesis / negative regulation of hippocampal neuron apoptotic process / positive regulation of cell projection organization / Metal sequestration by antimicrobial proteins / siderophore transport / response to kainic acid / response to mycotoxin / response to blue light ...positive regulation of hippocampal neuron apoptotic process / positive regulation of iron ion import across plasma membrane / positive regulation of endothelial tube morphogenesis / negative regulation of hippocampal neuron apoptotic process / positive regulation of cell projection organization / Metal sequestration by antimicrobial proteins / siderophore transport / response to kainic acid / response to mycotoxin / response to blue light / cellular response to increased oxygen levels / response to fructose / cellular response to X-ray / short-term memory / amyloid-beta complex / growth cone lamellipodium / cellular response to norepinephrine stimulus / growth cone filopodium / cellular response to interleukin-6 / microglia development / collateral sprouting in absence of injury / iron ion sequestering activity / Formyl peptide receptors bind formyl peptides and many other ligands / enterobactin binding / axo-dendritic transport / regulation of Wnt signaling pathway / hippocampal neuron apoptotic process / axon midline choice point recognition / astrocyte activation involved in immune response / regulation of synapse structure or activity / NMDA selective glutamate receptor signaling pathway / regulation of spontaneous synaptic transmission / mating behavior / response to herbicide / growth factor receptor binding / peptidase activator activity / Golgi-associated vesicle / PTB domain binding / positive regulation of amyloid fibril formation / Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / astrocyte projection / Lysosome Vesicle Biogenesis / neuron remodeling / response to iron(II) ion / Deregulated CDK5 triggers multiple neurodegenerative pathways in Alzheimer's disease models / nuclear envelope lumen / dendrite development / positive regulation of reactive oxygen species biosynthetic process / positive regulation of protein metabolic process / TRAF6 mediated NF-kB activation / negative regulation of long-term synaptic potentiation / signaling receptor activator activity / Advanced glycosylation endproduct receptor signaling / transition metal ion binding / main axon / The NLRP3 inflammasome / modulation of excitatory postsynaptic potential / regulation of multicellular organism growth / cellular response to interleukin-1 / intracellular copper ion homeostasis / ECM proteoglycans / regulation of presynapse assembly / long-term memory / positive regulation of T cell migration / response to insulin-like growth factor stimulus / neuronal dense core vesicle / Purinergic signaling in leishmaniasis infection / positive regulation of chemokine production / Notch signaling pathway / cellular response to manganese ion / swimming behavior / extrinsic apoptotic signaling pathway in absence of ligand / clathrin-coated pit / extracellular matrix organization / neuron projection maintenance / cellular response to nutrient levels / positive regulation of endothelial cell migration / astrocyte activation / positive regulation of calcium-mediated signaling / positive regulation of mitotic cell cycle / ionotropic glutamate receptor signaling pathway / Mitochondrial protein degradation / response to interleukin-1 / axonogenesis / protein serine/threonine kinase binding / platelet alpha granule lumen / regulation of neuron apoptotic process / cellular response to copper ion / cellular response to cAMP / positive regulation of glycolytic process / central nervous system development / dendritic shaft / endosome lumen / trans-Golgi network membrane / acute-phase response / positive regulation of long-term synaptic potentiation / positive regulation of interleukin-1 beta production / learning / adult locomotory behavior / Post-translational protein phosphorylation Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / MOLECULAR REPLACEMENT /  molecular replacement / Resolution: 1.5 Å molecular replacement / Resolution: 1.5 Å | ||||||
 Authors Authors | Eichinger, A. / Skerra, A. | ||||||
 Citation Citation |  Journal: Biochem.J. / Year: 2016 Journal: Biochem.J. / Year: 2016Title: High-affinity Anticalins with aggregation-blocking activity directed against the Alzheimer beta-amyloid peptide. Authors: Rauth, S. / Hinz, D. / Borger, M. / Uhrig, M. / Mayhaus, M. / Riemenschneider, M. / Skerra, A. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  4mvk.cif.gz 4mvk.cif.gz | 89.8 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb4mvk.ent.gz pdb4mvk.ent.gz | 67.5 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  4mvk.json.gz 4mvk.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/mv/4mvk https://data.pdbj.org/pub/pdb/validation_reports/mv/4mvk ftp://data.pdbj.org/pub/pdb/validation_reports/mv/4mvk ftp://data.pdbj.org/pub/pdb/validation_reports/mv/4mvk | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  4mviC  4mvlC  1l6mS C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 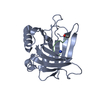
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
| #1: Protein | Mass: 21533.420 Da / Num. of mol.: 1 / Fragment: UNP residues 21-198 Mutation: Q28H,L36V,A40K,I41S,Q49W,L70G,R72G,K73T,D77H,W79K,C87S,N96R,Y100R,L103R,Y106A,K125V,S127Q,Y132S,K134N Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) Homo sapiens (human)Gene: engineered variant US7, HNL, LCN2, LCN2 (NGAL_HUMAN), NGAL Plasmid: pNGAL98-US7 / Production host:  |
|---|---|
| #2: Protein/peptide | Mass: 750.819 Da / Num. of mol.: 1 / Fragment: UNP residues 689-694 / Source method: obtained synthetically Details: The Abeta hexapeptide fragment VFFAED was synthesized with an acetylated N- and an amidated C-terminus. Source: (synth.)  Homo sapiens (human) / References: UniProt: P05067 Homo sapiens (human) / References: UniProt: P05067 |
| #3: Water | ChemComp-HOH / |
| Has protein modification | Y |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.07 Å3/Da / Density % sol: 40.69 % |
|---|---|
| Crystal grow | Temperature: 293 K / Method: vapor diffusion, hanging drop / pH: 6.5 Details: 27 % (w/v) PEG 8000, 100 mM MES, pH 6.5, vapor diffusion, hanging drop, temperature 293K |
-Data collection
| Diffraction | Mean temperature: 100 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  BESSY BESSY  / Beamline: 14.2 / Wavelength: 0.91841 Å / Beamline: 14.2 / Wavelength: 0.91841 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Detector | Type: MARMOSAIC 225 mm CCD / Detector: CCD / Date: May 18, 2010 / Details: mirrors | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation | Monochromator: Si 111 crystal / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation wavelength | Wavelength: 0.91841 Å / Relative weight: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection | Resolution: 1.5→42.571 Å / Num. all: 30318 / Num. obs: 30318 / % possible obs: 99.8 % / Observed criterion σ(F): 0 / Observed criterion σ(I): 2 / Redundancy: 7.1 % / Rsym value: 0.078 / Net I/σ(I): 13.2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection shell | Diffraction-ID: 1
|
-Phasing
| Phasing | Method:  molecular replacement molecular replacement | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Phasing MR |
|
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB ENTRY 1L6M Resolution: 1.5→42.57 Å / Cor.coef. Fo:Fc: 0.968 / Cor.coef. Fo:Fc free: 0.96 / WRfactor Rfree: 0.1959 / WRfactor Rwork: 0.1728 / Occupancy max: 1 / Occupancy min: 1 / FOM work R set: 0.9001 / SU B: 2.254 / SU ML: 0.041 / SU R Cruickshank DPI: 0.0677 / SU Rfree: 0.067 / Cross valid method: THROUGHOUT / σ(F): 0 / ESU R: 0.068 / ESU R Free: 0.067 / Stereochemistry target values: MAXIMUM LIKELIHOOD
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.2 Å / Solvent model: MASK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 115.46 Å2 / Biso mean: 24.3619 Å2 / Biso min: 8.45 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.5→42.57 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 1.5→1.539 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller












 PDBj
PDBj

















