| 登録情報 | データベース: PDB / ID: 4l0p
|
|---|
| タイトル | Structure of the human EphA3 receptor ligand binding domain complexed with ephrin-A5 |
|---|
 要素 要素 | - Ephrin type-A receptor 3
- Ephrin-A5
|
|---|
 キーワード キーワード | TRANSFERASE/TRANSFERASE RECEPTOR / beta-sandwich / Receptor Tyrosine Kinase / ephrin binding / TRANSFERASE-TRANSFERASE RECEPTOR complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
neurotrophin TRKC receptor binding / neurotrophin TRKB receptor binding / fasciculation of sensory neuron axon / fasciculation of motor neuron axon / negative regulation of substrate adhesion-dependent cell spreading / transmembrane-ephrin receptor activity / synaptic membrane adhesion / GPI-linked ephrin receptor activity / collateral sprouting / cellular response to follicle-stimulating hormone stimulus ...neurotrophin TRKC receptor binding / neurotrophin TRKB receptor binding / fasciculation of sensory neuron axon / fasciculation of motor neuron axon / negative regulation of substrate adhesion-dependent cell spreading / transmembrane-ephrin receptor activity / synaptic membrane adhesion / GPI-linked ephrin receptor activity / collateral sprouting / cellular response to follicle-stimulating hormone stimulus / regulation of epithelial to mesenchymal transition / ephrin receptor activity / regulation of insulin secretion involved in cellular response to glucose stimulus / positive regulation of collateral sprouting / neurotrophin TRKA receptor binding / negative regulation of endocytosis / chemorepellent activity / transmembrane receptor protein tyrosine kinase activator activity / regulation of cell morphogenesis / retinal ganglion cell axon guidance / EPH-Ephrin signaling / positive regulation of synapse assembly / regulation of GTPase activity / positive regulation of peptidyl-tyrosine phosphorylation / regulation of focal adhesion assembly / EPHA-mediated growth cone collapse / regulation of cell-cell adhesion / basement membrane / EPH-ephrin mediated repulsion of cells / ephrin receptor signaling pathway / ephrin receptor binding / cellular response to retinoic acid / cellular response to forskolin / regulation of microtubule cytoskeleton organization / axon guidance / peptidyl-tyrosine phosphorylation / adherens junction / positive regulation of protein localization to plasma membrane / regulation of actin cytoskeleton organization / receptor protein-tyrosine kinase / positive regulation of neuron projection development / GABA-ergic synapse / caveola / cell migration / nervous system development / actin cytoskeleton / nuclear membrane / early endosome / positive regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction / cell adhesion / external side of plasma membrane / dendrite / extracellular region / nucleoplasm / ATP binding / plasma membrane / cytosol類似検索 - 分子機能 Ephrin-A ectodomain / Ephrin receptor-binding domain / Ephrin, conserved site / Ephrin / Ephrin / Ephrin receptor-binding (ephrin RBD) domain signature. / Ephrin receptor-binding (ephrin RBD) domain profile. / Ephrin type-A receptor 3, ligand binding domain / Tyrosine-protein kinase ephrin type A/B receptor-like / Tyrosine-protein kinase ephrin type A/B receptor-like ...Ephrin-A ectodomain / Ephrin receptor-binding domain / Ephrin, conserved site / Ephrin / Ephrin / Ephrin receptor-binding (ephrin RBD) domain signature. / Ephrin receptor-binding (ephrin RBD) domain profile. / Ephrin type-A receptor 3, ligand binding domain / Tyrosine-protein kinase ephrin type A/B receptor-like / Tyrosine-protein kinase ephrin type A/B receptor-like / Ephrin receptor type-A /type-B / Ephrin receptor ligand binding domain / Tyrosine-protein kinase, receptor class V, conserved site / Ephrin receptor, transmembrane domain / : / Ephrin receptor ligand binding domain / Ephrin type-A receptor 2 transmembrane domain / Receptor tyrosine kinase class V signature 1. / Receptor tyrosine kinase class V signature 2. / Eph receptor ligand-binding domain profile. / Ephrin receptor ligand binding domain / Putative ephrin-receptor like / SAM domain (Sterile alpha motif) / Galactose-binding domain-like / SAM domain profile. / Sterile alpha motif. / Sterile alpha motif domain / Cupredoxins - blue copper proteins / Sterile alpha motif/pointed domain superfamily / Growth factor receptor cysteine-rich domain superfamily / Fibronectin type III domain / EGF-like domain signature 2. / Cupredoxin / Fibronectin type 3 domain / Fibronectin type-III domain profile. / Galactose-binding-like domain superfamily / Fibronectin type III / Fibronectin type III superfamily / Tyrosine-protein kinase, catalytic domain / Tyrosine kinase, catalytic domain / Tyrosine protein kinases specific active-site signature. / Tyrosine-protein kinase, active site / Serine-threonine/tyrosine-protein kinase, catalytic domain / Protein tyrosine and serine/threonine kinase / Jelly Rolls / Protein kinase, ATP binding site / Protein kinases ATP-binding region signature. / Immunoglobulin-like fold / Protein kinase domain profile. / Protein kinase domain / Protein kinase-like domain superfamily / Immunoglobulin-like / Sandwich / Mainly Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.26 Å 分子置換 / 解像度: 2.26 Å |
|---|
 データ登録者 データ登録者 | Forse, G.J. / Kolatkar, A.R. / Kuhn, P. |
|---|
 引用 引用 |  ジャーナル: Plos One / 年: 2015 ジャーナル: Plos One / 年: 2015
タイトル: Distinctive Structure of the EphA3/Ephrin-A5 Complex Reveals a Dual Mode of Eph Receptor Interaction for Ephrin-A5.
著者: Forse, G.J. / Uson, M.L. / Nasertorabi, F. / Kolatkar, A. / Lamberto, I. / Pasquale, E.B. / Kuhn, P. |
|---|
| 履歴 | | 登録 | 2013年5月31日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2014年6月11日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2015年4月1日 | Group: Other |
|---|
| 改定 1.2 | 2015年7月1日 | Group: Database references |
|---|
| 改定 1.3 | 2017年11月15日 | Group: Refinement description / カテゴリ: software / Item: _software.name |
|---|
| 改定 2.0 | 2020年7月29日 | Group: Atomic model / Data collection ...Atomic model / Data collection / Database references / Derived calculations / Structure summary
カテゴリ: atom_site / chem_comp ...atom_site / chem_comp / entity / pdbx_branch_scheme / pdbx_chem_comp_identifier / pdbx_entity_branch / pdbx_entity_branch_descriptor / pdbx_entity_branch_link / pdbx_entity_branch_list / pdbx_entity_nonpoly / pdbx_nonpoly_scheme / pdbx_struct_assembly_gen / pdbx_struct_conn_angle / struct_asym / struct_conn / struct_ref_seq_dif / struct_site / struct_site_gen
Item: _atom_site.B_iso_or_equiv / _atom_site.Cartn_x ..._atom_site.B_iso_or_equiv / _atom_site.Cartn_x / _atom_site.Cartn_y / _atom_site.Cartn_z / _atom_site.auth_asym_id / _atom_site.auth_atom_id / _atom_site.auth_comp_id / _atom_site.auth_seq_id / _atom_site.label_asym_id / _atom_site.label_atom_id / _atom_site.label_comp_id / _atom_site.label_entity_id / _atom_site.type_symbol / _chem_comp.name / _chem_comp.type / _entity.formula_weight / _entity.pdbx_description / _entity.pdbx_number_of_molecules / _entity.src_method / _entity.type / _pdbx_struct_assembly_gen.asym_id_list / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _struct_conn.conn_type_id / _struct_conn.id / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.pdbx_role / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_ref_seq_dif.details
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 2.1 | 2023年9月20日 | Group: Data collection / Database references ...Data collection / Database references / Refinement description / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
| 改定 2.2 | 2024年11月6日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.26 Å
分子置換 / 解像度: 2.26 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Plos One / 年: 2015
ジャーナル: Plos One / 年: 2015 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4l0p.cif.gz
4l0p.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4l0p.ent.gz
pdb4l0p.ent.gz PDB形式
PDB形式 4l0p.json.gz
4l0p.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 4l0p_validation.pdf.gz
4l0p_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 4l0p_full_validation.pdf.gz
4l0p_full_validation.pdf.gz 4l0p_validation.xml.gz
4l0p_validation.xml.gz 4l0p_validation.cif.gz
4l0p_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/l0/4l0p
https://data.pdbj.org/pub/pdb/validation_reports/l0/4l0p ftp://data.pdbj.org/pub/pdb/validation_reports/l0/4l0p
ftp://data.pdbj.org/pub/pdb/validation_reports/l0/4l0p
 リンク
リンク 集合体
集合体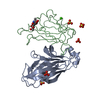
 要素
要素 Homo sapiens (ヒト) / 遺伝子: EPHA3, EPHA3_HUMAN, ETK, ETK1, HEK, TYRO4 / プラスミド: pET32b / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: EPHA3, EPHA3_HUMAN, ETK, ETK1, HEK, TYRO4 / プラスミド: pET32b / 発現宿主: 
 Homo sapiens (ヒト) / 遺伝子: EFNA5, EFNA5_HUMAN, EPLG7, LERK7 / プラスミド: pFASTBAC / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: EFNA5, EFNA5_HUMAN, EPLG7, LERK7 / プラスミド: pFASTBAC / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P52803
Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P52803




 X線回折 / 使用した結晶の数: 2
X線回折 / 使用した結晶の数: 2  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 23-ID-B / 波長: 1.0332 Å
/ ビームライン: 23-ID-B / 波長: 1.0332 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj











