| 登録情報 | データベース: PDB / ID: 4jzr
|
|---|
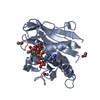
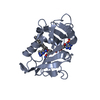
| タイトル | Structure of Prolyl Hydroxylase Domain-containing Protein (PHD) with Inhibitors |
|---|
 要素 要素 | Egl nine homolog 1 |
|---|
 キーワード キーワード | OXIDOREDUCTASE / Prolyl hydroxylase |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
peptidyl-proline 4-dioxygenase activity / hypoxia-inducible factor-proline dioxygenase activity / hypoxia-inducible factor-proline dioxygenase / negative regulation of hypoxia-inducible factor-1alpha signaling pathway / peptidyl-proline dioxygenase activity / regulation protein catabolic process at postsynapse / intracellular oxygen homeostasis / regulation of modification of postsynaptic structure / labyrinthine layer development / 2-oxoglutarate-dependent dioxygenase activity ...peptidyl-proline 4-dioxygenase activity / hypoxia-inducible factor-proline dioxygenase activity / hypoxia-inducible factor-proline dioxygenase / negative regulation of hypoxia-inducible factor-1alpha signaling pathway / peptidyl-proline dioxygenase activity / regulation protein catabolic process at postsynapse / intracellular oxygen homeostasis / regulation of modification of postsynaptic structure / labyrinthine layer development / 2-oxoglutarate-dependent dioxygenase activity / heart trabecula formation / cardiac muscle tissue morphogenesis / L-ascorbic acid binding / response to nitric oxide / ventricular septum morphogenesis / enzyme inhibitor activity / regulation of angiogenesis / regulation of neuron apoptotic process / ferrous iron binding / Oxygen-dependent proline hydroxylation of Hypoxia-inducible Factor Alpha / cellular response to hypoxia / intracellular iron ion homeostasis / response to hypoxia / postsynaptic density / intracellular membrane-bounded organelle / glutamatergic synapse / enzyme binding / positive regulation of transcription by RNA polymerase II / zinc ion binding / nucleus / cytoplasm / cytosol類似検索 - 分子機能 : / Prolyl 4-hydroxylase alpha subunit, Fe(2+) 2OG dioxygenase domain / 2OG-Fe(II) oxygenase superfamily / Prolyl 4-hydroxylase, alpha subunit / Prolyl 4-hydroxylase alpha subunit homologues. / MYND finger / Zinc finger MYND-type signature. / Zinc finger, MYND-type / Zinc finger MYND-type profile. / q2cbj1_9rhob like domain ...: / Prolyl 4-hydroxylase alpha subunit, Fe(2+) 2OG dioxygenase domain / 2OG-Fe(II) oxygenase superfamily / Prolyl 4-hydroxylase, alpha subunit / Prolyl 4-hydroxylase alpha subunit homologues. / MYND finger / Zinc finger MYND-type signature. / Zinc finger, MYND-type / Zinc finger MYND-type profile. / q2cbj1_9rhob like domain / Oxoglutarate/iron-dependent dioxygenase / Fe(2+) 2-oxoglutarate dioxygenase domain profile. / Jelly Rolls / Sandwich / Mainly Beta類似検索 - ドメイン・相同性 Chem-4JR / NICKEL (II) ION / Egl nine homolog 1類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.1 Å 分子置換 / 解像度: 2.1 Å |
|---|
 データ登録者 データ登録者 | Ma, Y. / Yang, L. |
|---|
 引用 引用 |  ジャーナル: Bioorg.Med.Chem. / 年: 2013 ジャーナル: Bioorg.Med.Chem. / 年: 2013
タイトル: Novel complex crystal structure of prolyl hydroxylase domain-containing protein 2 (PHD2): 2,8-Diazaspiro[4.5]decan-1-ones as potent, orally bioavailable PHD2 inhibitors
著者: Deng, G. / Zhao, B. / Ma, Y. / Xu, Q. / Wang, H. / Yang, L. / Zhang, Q. / Guo, T.B. / Zhang, W. / Jiao, Y. / Cai, X. / Zhang, J. / Liu, H. / Guan, X. / Lu, H. / Xiang, J. / Elliott, J.D. / Lin, X. / Ren, F. |
|---|
| 履歴 | | 登録 | 2013年4月3日 | 登録サイト: RCSB / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2013年10月30日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2024年10月16日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Structure summary
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_entry_details / pdbx_modification_feature / pdbx_struct_conn_angle / struct_conn / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.1 Å
分子置換 / 解像度: 2.1 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Bioorg.Med.Chem. / 年: 2013
ジャーナル: Bioorg.Med.Chem. / 年: 2013 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4jzr.cif.gz
4jzr.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4jzr.ent.gz
pdb4jzr.ent.gz PDB形式
PDB形式 4jzr.json.gz
4jzr.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 4jzr_validation.pdf.gz
4jzr_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 4jzr_full_validation.pdf.gz
4jzr_full_validation.pdf.gz 4jzr_validation.xml.gz
4jzr_validation.xml.gz 4jzr_validation.cif.gz
4jzr_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/jz/4jzr
https://data.pdbj.org/pub/pdb/validation_reports/jz/4jzr ftp://data.pdbj.org/pub/pdb/validation_reports/jz/4jzr
ftp://data.pdbj.org/pub/pdb/validation_reports/jz/4jzr リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: C1orf12, EGLN1, PNAS-118, PNAS-137 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: C1orf12, EGLN1, PNAS-118, PNAS-137 / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SSRF
SSRF  / ビームライン: BL17U / 波長: 0.97915 Å
/ ビームライン: BL17U / 波長: 0.97915 Å 分子置換
分子置換 解析
解析 分子置換 / 解像度: 2.1→50 Å / Cor.coef. Fo:Fc: 0.935 / Cor.coef. Fo:Fc free: 0.928 / WRfactor Rfree: 0.258 / WRfactor Rwork: 0.2255 / Occupancy max: 1 / Occupancy min: 0.5 / FOM work R set: 0.7998 / SU B: 4.898 / SU ML: 0.129 / SU R Cruickshank DPI: 0.2091 / SU Rfree: 0.1794 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.209 / ESU R Free: 0.179 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD
分子置換 / 解像度: 2.1→50 Å / Cor.coef. Fo:Fc: 0.935 / Cor.coef. Fo:Fc free: 0.928 / WRfactor Rfree: 0.258 / WRfactor Rwork: 0.2255 / Occupancy max: 1 / Occupancy min: 0.5 / FOM work R set: 0.7998 / SU B: 4.898 / SU ML: 0.129 / SU R Cruickshank DPI: 0.2091 / SU Rfree: 0.1794 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R: 0.209 / ESU R Free: 0.179 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj