[English] 日本語
 Yorodumi
Yorodumi- PDB-4hvw: Crystal structure of the T98E c-Src-SH3 domain mutant in complex ... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 4hvw | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal structure of the T98E c-Src-SH3 domain mutant in complex with the high affinity peptide VSL12 | ||||||
 Components Components |
| ||||||
 Keywords Keywords | Signaling Protein/Peptide / beta shandwich / SH3 like barrel / Kinase / Proline Rich Motifs / Signaling Protein-Peptide complex | ||||||
| Function / homology |  Function and homology information Function and homology informationSignaling by ERBB2 / Nuclear signaling by ERBB4 / Signaling by SCF-KIT / Regulation of KIT signaling / Signaling by EGFR / GAB1 signalosome / Regulation of gap junction activity / FCGR activation / PECAM1 interactions / Co-stimulation by CD28 ...Signaling by ERBB2 / Nuclear signaling by ERBB4 / Signaling by SCF-KIT / Regulation of KIT signaling / Signaling by EGFR / GAB1 signalosome / Regulation of gap junction activity / FCGR activation / PECAM1 interactions / Co-stimulation by CD28 / Co-inhibition by CTLA4 / EPHA-mediated growth cone collapse / Ephrin signaling / G alpha (i) signalling events / GP1b-IX-V activation signalling / Thrombin signalling through proteinase activated receptors (PARs) / VEGFR2 mediated cell proliferation / RET signaling / Receptor Mediated Mitophagy / ADP signalling through P2Y purinoceptor 1 / RAF activation / PIP3 activates AKT signaling / EPH-ephrin mediated repulsion of cells / PI5P, PP2A and IER3 Regulate PI3K/AKT Signaling / : / Downstream signal transduction / Downregulation of ERBB4 signaling / Cyclin D associated events in G1 / Regulation of RUNX3 expression and activity / MAP2K and MAPK activation / Integrin signaling / GRB2:SOS provides linkage to MAPK signaling for Integrins / : / MET activates PTK2 signaling / Extra-nuclear estrogen signaling / EPHB-mediated forward signaling / p130Cas linkage to MAPK signaling for integrins / VEGFA-VEGFR2 Pathway / connexin binding / negative regulation of intrinsic apoptotic signaling pathway / progesterone receptor signaling pathway / immune system process / negative regulation of extrinsic apoptotic signaling pathway / non-membrane spanning protein tyrosine kinase activity / non-specific protein-tyrosine kinase / epidermal growth factor receptor signaling pathway / cell-cell junction / cell junction / protein tyrosine kinase activity / protein phosphatase binding / cell differentiation / cytoskeleton / cell adhesion / endosome membrane / regulation of cell cycle / mitochondrial inner membrane / signaling receptor binding / focal adhesion / heme binding / perinuclear region of cytoplasm / protein-containing complex / ATP binding / nucleus / membrane / plasma membrane / cytosol Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / MOLECULAR REPLACEMENT /  molecular replacement / Resolution: 0.98 Å molecular replacement / Resolution: 0.98 Å | ||||||
 Authors Authors | Camara-Artigas, A. | ||||||
 Citation Citation |  Journal: Acta Crystallogr.,Sect.D / Year: 2013 Journal: Acta Crystallogr.,Sect.D / Year: 2013Title: Atomic resolution structures of the c-Src SH3 domain in complex with two high-affinity peptides from classes I and II. Authors: Bacarizo, J. / Camara-Artigas, A. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  4hvw.cif.gz 4hvw.cif.gz | 62.7 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb4hvw.ent.gz pdb4hvw.ent.gz | 46.6 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  4hvw.json.gz 4hvw.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/hv/4hvw https://data.pdbj.org/pub/pdb/validation_reports/hv/4hvw ftp://data.pdbj.org/pub/pdb/validation_reports/hv/4hvw ftp://data.pdbj.org/pub/pdb/validation_reports/hv/4hvw | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  4hvuC  4hvvC  3fj5S C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 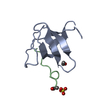
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 2 | 
| ||||||||
| Unit cell |
| ||||||||
| Components on special symmetry positions |
| ||||||||
| Details | biological unit is the same as asym. |
- Components
Components
| #1: Protein | Mass: 6962.573 Da / Num. of mol.: 1 / Fragment: SH3 domain / Mutation: T98E, T125S, Q128R Source method: isolated from a genetically manipulated source Source: (gene. exp.)   References: UniProt: P00523, non-specific protein-tyrosine kinase |
|---|---|
| #2: Protein/peptide | Mass: 1343.660 Da / Num. of mol.: 1 / Source method: obtained synthetically Details: High affinity peptide designed from phage display experiments |
| #3: Chemical | ChemComp-ACE / |
| #4: Chemical | ChemComp-SO4 / |
| #5: Water | ChemComp-HOH / |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.09 Å3/Da / Density % sol: 41.13 % |
|---|---|
| Crystal grow | Temperature: 298 K / Method: vapor diffusion, hanging drop / pH: 5 Details: 1.7 M Ammonium sulphate, 5% PEG 300, 10% glycerol and 0.1 M sodium acetate, vapor diffusion, hanging drop, temperature 298K |
-Data collection
| Diffraction | Mean temperature: 100 K | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  ALBA ALBA  / Beamline: XALOC / Wavelength: 0.97951 Å / Beamline: XALOC / Wavelength: 0.97951 Å | ||||||||||||||||||
| Detector | Type: DECTRIS PILATUS 6M / Detector: PIXEL / Date: Jul 13, 2012 Details: vertical focusing mirror (VFM) and a horizontal focusing mirror(HFM), manufactured by IRELEC. | ||||||||||||||||||
| Radiation | Monochromator: Si(111) channel-cut crystal monochromator and a pair of KB mirrors Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | ||||||||||||||||||
| Radiation wavelength | Wavelength: 0.97951 Å / Relative weight: 1 | ||||||||||||||||||
| Reflection | Resolution: 0.98→32.426 Å / Num. obs: 72675 / % possible obs: 98.3 % / Observed criterion σ(F): 0 / Observed criterion σ(I): 0 / Redundancy: 4.2 % / Biso Wilson estimate: 8.337 Å2 / Rmerge(I) obs: 0.051 / Net I/σ(I): 19.5 | ||||||||||||||||||
| Reflection shell |
|
-Phasing
| Phasing | Method:  molecular replacement molecular replacement |
|---|
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB entry 3FJ5 Resolution: 0.98→18.721 Å / Occupancy max: 1 / Occupancy min: 0.22 / SU ML: 0.06 / σ(F): 1.33 / Phase error: 10.53 / Stereochemistry target values: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å / Solvent model: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 14.4743 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 0.98→18.721 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
|
 Movie
Movie Controller
Controller















 PDBj
PDBj




