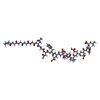
登録情報 データベース : PDB / ID : 3vxfタイトル X/N Joint refinement of Human alpha-thrombin-Bivalirudin complex PD5 (BIVALIRUDIN) x 2 Thrombin heavy chain Thrombin light chain キーワード / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)unidentified (未定義) 手法 / / / / 解像度 : 1.602 Å データ登録者 Yamada, T. / Kurihara, K. / Masumi, K. / Tamada, T. / Tomoyori, K. / Ohnishi, Y. / Tanaka, I. / Kuroki, R. / Niimura, N. ジャーナル : Biochim.Biophys.Acta / 年 : 2013タイトル : Neutron and X-ray crystallographic analysis of the human alpha-thrombin-bivalirudin complex at pD 5.0: protonation states and hydration structure of the enzyme-product complex著者 : Yamada, T. / Kurihara, K. / Ohnishi, Y. / Tamada, T. / Tomoyori, K. / Masumi, K. / Tanaka, I. / Kuroki, R. / Niimura, N. 履歴 登録 2012年9月12日 登録サイト / 処理サイト 改定 1.0 2013年9月4日 Provider / タイプ 改定 1.1 2017年11月22日 Group / カテゴリ 改定 1.2 2018年11月28日 Group / Source and taxonomy / カテゴリ / pdbx_entity_src_synItem _diffrn_source.pdbx_synchrotron_beamline / _diffrn_source.pdbx_synchrotron_site ... _diffrn_source.pdbx_synchrotron_beamline / _diffrn_source.pdbx_synchrotron_site / _diffrn_source.type / _pdbx_entity_src_syn.ncbi_taxonomy_id / _pdbx_entity_src_syn.organism_scientific 改定 1.3 2020年7月29日 Group / Derived calculations / Structure summaryカテゴリ chem_comp / entity ... chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / struct_conn / struct_site / struct_site_gen Item _chem_comp.name / _chem_comp.type ... _chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.pdbx_ptnr1_PDB_ins_code / _struct_conn.pdbx_ptnr2_PDB_ins_code / _struct_conn.pdbx_role / _struct_conn.pdbx_value_order / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id 解説 / Provider / タイプ
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 / 中性子回折 /
X線回折 / 中性子回折 /  シンクロトロン / NUCLEAR REACTOR / 解像度: 1.602 Å
シンクロトロン / NUCLEAR REACTOR / 解像度: 1.602 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Biochim.Biophys.Acta / 年: 2013
ジャーナル: Biochim.Biophys.Acta / 年: 2013 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3vxf.cif.gz
3vxf.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3vxf.ent.gz
pdb3vxf.ent.gz PDB形式
PDB形式 3vxf.json.gz
3vxf.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 3vxf_validation.pdf.gz
3vxf_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 3vxf_full_validation.pdf.gz
3vxf_full_validation.pdf.gz 3vxf_validation.xml.gz
3vxf_validation.xml.gz 3vxf_validation.cif.gz
3vxf_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/vx/3vxf
https://data.pdbj.org/pub/pdb/validation_reports/vx/3vxf ftp://data.pdbj.org/pub/pdb/validation_reports/vx/3vxf
ftp://data.pdbj.org/pub/pdb/validation_reports/vx/3vxf リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 参照: UniProt: P00734, thrombin
Homo sapiens (ヒト) / 参照: UniProt: P00734, thrombin


 Homo sapiens (ヒト) / 参照: UniProt: P00734, thrombin
Homo sapiens (ヒト) / 参照: UniProt: P00734, thrombin 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj