| 登録情報 | データベース: PDB / ID: 3nqs
|
|---|
| タイトル | Crystal Structure of Inducible Nitric Oxide Synthase with N-Nitrosated-pterin |
|---|
 要素 要素 | Nitric oxide synthase, inducible |
|---|
 キーワード キーワード | OXIDOREDUCTASE / Nitrosylation / Nitrosation / N-NO-pterin |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
Nitric oxide stimulates guanylate cyclase / ROS and RNS production in phagocytes / peptidyl-cysteine S-nitrosylation / Peroxisomal protein import / prostaglandin secretion / tetrahydrobiopterin binding / arginine binding / superoxide metabolic process / regulation of cytokine production involved in inflammatory response / cortical cytoskeleton ...Nitric oxide stimulates guanylate cyclase / ROS and RNS production in phagocytes / peptidyl-cysteine S-nitrosylation / Peroxisomal protein import / prostaglandin secretion / tetrahydrobiopterin binding / arginine binding / superoxide metabolic process / regulation of cytokine production involved in inflammatory response / cortical cytoskeleton / cellular response to cytokine stimulus / Fc-gamma receptor signaling pathway involved in phagocytosis / nitric-oxide synthase (NADPH) / nitric-oxide synthase activity / L-arginine catabolic process / nitric oxide biosynthetic process / regulation of insulin secretion / positive regulation of interleukin-8 production / response to bacterium / circadian rhythm / negative regulation of protein catabolic process / cellular response to type II interferon / positive regulation of interleukin-6 production / cellular response to xenobiotic stimulus / peroxisome / FMN binding / flavin adenine dinucleotide binding / NADP binding / regulation of cell population proliferation / cellular response to lipopolysaccharide / response to lipopolysaccharide / calmodulin binding / response to hypoxia / defense response to bacterium / inflammatory response / negative regulation of gene expression / heme binding / perinuclear region of cytoplasm / protein homodimerization activity / metal ion binding / cytoplasm / cytosol類似検索 - 分子機能 Bovine Endothelial Nitric Oxide Synthase Heme Domain; Chain: A,domain 3 / Nitric Oxide Synthase; Chain A, domain 3 / Nitric Oxide Synthase; Chain A, domain 1 / Nitric Oxide Synthase; Chain A, domain 1 / Nitric Oxide Synthase;Heme Domain; Chain A, domain 2 / Nitric Oxide Synthase;Heme Domain;Chain A domain 2 / Nitric-oxide synthase, eukaryote / Nitric oxide synthase, N-terminal / Nitric oxide synthase, N-terminal domain superfamily / Nitric oxide synthase, domain 2 superfamily ...Bovine Endothelial Nitric Oxide Synthase Heme Domain; Chain: A,domain 3 / Nitric Oxide Synthase; Chain A, domain 3 / Nitric Oxide Synthase; Chain A, domain 1 / Nitric Oxide Synthase; Chain A, domain 1 / Nitric Oxide Synthase;Heme Domain; Chain A, domain 2 / Nitric Oxide Synthase;Heme Domain;Chain A domain 2 / Nitric-oxide synthase, eukaryote / Nitric oxide synthase, N-terminal / Nitric oxide synthase, N-terminal domain superfamily / Nitric oxide synthase, domain 2 superfamily / Nitric oxide synthase, domain 1 superfamily / Nitric oxide synthase, domain 3 superfamily / : / Nitric oxide synthase, oxygenase domain / Nitric oxide synthase (NOS) signature. / Sulfite reductase [NADPH] flavoprotein alpha-component-like, FAD-binding / NADPH-cytochrome p450 reductase, FAD-binding, alpha-helical domain superfamily / FAD binding domain / Flavodoxin-like / Flavoprotein pyridine nucleotide cytochrome reductase / Flavodoxin / Flavodoxin-like domain profile. / Flavodoxin/nitric oxide synthase / Oxidoreductase FAD/NAD(P)-binding / Oxidoreductase NAD-binding domain / FAD-binding domain, ferredoxin reductase-type / Ferredoxin-NADP reductase (FNR), nucleotide-binding domain / Ferredoxin reductase-type FAD binding domain profile. / Riboflavin synthase-like beta-barrel / Flavoprotein-like superfamily / Alpha-Beta Complex / Alpha Beta類似検索 - ドメイン・相同性 Chem-AT2 / 5,6,7,8-TETRAHYDROBIOPTERIN / PROTOPORPHYRIN IX CONTAINING FE / NITRIC OXIDE / Nitric oxide synthase, inducible類似検索 - 構成要素 |
|---|
| 生物種 |   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.2 Å 分子置換 / 解像度: 2.2 Å |
|---|
 データ登録者 データ登録者 | Rosenfeld, R.J. / Getzoff, E.D. / Tainer, J.A. |
|---|
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2010 ジャーナル: J.Biol.Chem. / 年: 2010
タイトル: Nitric-oxide synthase forms N-NO-pterin and S-NO-cys: implications for activity, allostery, and regulation.
著者: Rosenfeld, R.J. / Bonaventura, J. / Szymczyna, B.R. / MacCoss, M.J. / Arvai, A.S. / Yates, J.R. / Tainer, J.A. / Getzoff, E.D. |
|---|
| 履歴 | | 登録 | 2010年6月29日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2010年7月21日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2020年7月29日 | Group: Data collection / Derived calculations / Structure summary
カテゴリ: chem_comp / entity ...chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / struct_conn / struct_conn_type / struct_site / struct_site_gen
Item: _chem_comp.mon_nstd_flag / _chem_comp.name ..._chem_comp.mon_nstd_flag / _chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _struct_conn.conn_type_id / _struct_conn.id / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn_type.id
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 1.3 | 2023年9月6日 | Group: Data collection / Database references ...Data collection / Database references / Refinement description / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.2 Å
分子置換 / 解像度: 2.2 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Biol.Chem. / 年: 2010
ジャーナル: J.Biol.Chem. / 年: 2010 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3nqs.cif.gz
3nqs.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3nqs.ent.gz
pdb3nqs.ent.gz PDB形式
PDB形式 3nqs.json.gz
3nqs.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 3nqs_validation.pdf.gz
3nqs_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 3nqs_full_validation.pdf.gz
3nqs_full_validation.pdf.gz 3nqs_validation.xml.gz
3nqs_validation.xml.gz 3nqs_validation.cif.gz
3nqs_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/nq/3nqs
https://data.pdbj.org/pub/pdb/validation_reports/nq/3nqs ftp://data.pdbj.org/pub/pdb/validation_reports/nq/3nqs
ftp://data.pdbj.org/pub/pdb/validation_reports/nq/3nqs
 リンク
リンク 集合体
集合体


 要素
要素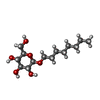





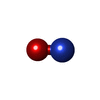
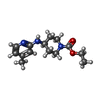











 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SSRL
SSRL  / ビームライン: BL7-1 / 波長: 0.98 Å
/ ビームライン: BL7-1 / 波長: 0.98 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj












