+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2z0p | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of PH domain of Bruton's tyrosine kinase | ||||||
 要素 要素 | Tyrosine-protein kinase BTK | ||||||
 キーワード キーワード | SIGNALING PROTEIN / PH domain / PIP3C4 / ATP-binding / Disease mutation / Kinase / Membrane / Metal-binding / Nucleotide-binding / Nucleus / Phosphorylation / SH2 domain / SH3 domain / Transferase / Tyrosine-protein kinase / Zinc-finger / Structural Genomics / NPPSFA / National Project on Protein Structural and Functional Analyses / RIKEN Structural Genomics/Proteomics Initiative / RSGI | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of B cell cytokine production / proteoglycan catabolic process / monocyte proliferation / positive regulation of interleukin-17A production / regulation of B cell apoptotic process / eosinophil homeostasis / positive regulation of type III hypersensitivity / B cell affinity maturation / positive regulation of synoviocyte proliferation / histamine secretion by mast cell ...regulation of B cell cytokine production / proteoglycan catabolic process / monocyte proliferation / positive regulation of interleukin-17A production / regulation of B cell apoptotic process / eosinophil homeostasis / positive regulation of type III hypersensitivity / B cell affinity maturation / positive regulation of synoviocyte proliferation / histamine secretion by mast cell / neutrophil homeostasis / cellular response to molecule of fungal origin / positive regulation of type I hypersensitivity / cellular response to interleukin-7 / MyD88 deficiency (TLR2/4) / MyD88-dependent toll-like receptor signaling pathway / IRAK4 deficiency (TLR2/4) / positive regulation of immunoglobulin production / MyD88:MAL(TIRAP) cascade initiated on plasma membrane / positive regulation of B cell differentiation / positive regulation of NLRP3 inflammasome complex assembly / phospholipase activator activity / negative regulation of interleukin-10 production / B cell activation / negative regulation of B cell proliferation / Fc-epsilon receptor signaling pathway / mesoderm development / phosphatidylinositol-3,4,5-trisphosphate binding / phospholipase binding / RHO GTPases Activate WASPs and WAVEs / positive regulation of B cell proliferation / positive regulation of phagocytosis / cell maturation / FCERI mediated Ca+2 mobilization / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / apoptotic signaling pathway / FCGR3A-mediated phagocytosis / B cell receptor signaling pathway / non-specific protein-tyrosine kinase / calcium-mediated signaling / non-membrane spanning protein tyrosine kinase activity / Regulation of actin dynamics for phagocytic cup formation / G beta:gamma signalling through BTK / cellular response to reactive oxygen species / peptidyl-tyrosine phosphorylation / positive regulation of interleukin-6 production / positive regulation of tumor necrosis factor production / G alpha (12/13) signalling events / DAP12 signaling / positive regulation of NF-kappaB transcription factor activity / T cell receptor signaling pathway / ER-Phagosome pathway / cytoplasmic vesicle / G alpha (q) signalling events / protein tyrosine kinase activity / adaptive immune response / Potential therapeutics for SARS / response to lipopolysaccharide / intracellular signal transduction / membrane raft / protein phosphorylation / innate immune response / perinuclear region of cytoplasm / ATP binding / identical protein binding / nucleus / metal ion binding / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.58 Å 分子置換 / 解像度: 2.58 Å | ||||||
 データ登録者 データ登録者 | Murayama, K. / Kato-Murayama, M. / Mishima, C. / Shirouzu, M. / Yokoyama, S. / RIKEN Structural Genomics/Proteomics Initiative (RSGI) | ||||||
 引用 引用 |  ジャーナル: Biochem.Biophys.Res.Commun. / 年: 2008 ジャーナル: Biochem.Biophys.Res.Commun. / 年: 2008タイトル: Crystal structure of the Bruton's tyrosine kinase PH domain with phosphatidylinositol 著者: Murayama, K. / Kato-Murayama, M. / Mishima, C. / Akasaka, R. / Shirouzu, M. / Fukui, Y. / Yokoyama, S. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2z0p.cif.gz 2z0p.cif.gz | 147.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2z0p.ent.gz pdb2z0p.ent.gz | 117.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2z0p.json.gz 2z0p.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/z0/2z0p https://data.pdbj.org/pub/pdb/validation_reports/z0/2z0p ftp://data.pdbj.org/pub/pdb/validation_reports/z0/2z0p ftp://data.pdbj.org/pub/pdb/validation_reports/z0/2z0p | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ | 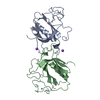 1btkS S: 精密化の開始モデル |
|---|---|
| 類似構造データ | |
| その他のデータベース |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 5 | 
| ||||||||
| 6 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 19983.014 Da / 分子数: 4 / 断片: PH domain / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 細胞株 (発現宿主): SF9 Homo sapiens (ヒト) / 細胞株 (発現宿主): SF9発現宿主:  参照: UniProt: Q06187, non-specific protein-tyrosine kinase #2: 化合物 | ChemComp-ZN / #3: 化合物 | ChemComp-4PT / ( #4: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.71 Å3/Da / 溶媒含有率: 54.64 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 6.5 詳細: 25% PEG3350, 0.2M Li2SO4, 0.1M MES, pH 6.5, VAPOR DIFFUSION, HANGING DROP, temperature 293K |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  Photon Factory Photon Factory  / ビームライン: AR-NW12A / 波長: 1 Å / ビームライン: AR-NW12A / 波長: 1 Å |
| 検出器 | タイプ: ADSC QUANTUM 210 / 検出器: CCD / 日付: 2006年12月2日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1 Å / 相対比: 1 |
| 反射 | 解像度: 2.58→29.67 Å / Num. obs: 26621 / % possible obs: 98.5 % / Observed criterion σ(F): -3 / 冗長度: 3.7 % / Biso Wilson estimate: 48.8 Å2 / Rsym value: 0.037 / Net I/σ(I): 24.9 |
| 反射 シェル | 解像度: 2.58→2.67 Å / Rsym value: 0.114 / % possible all: 99.7 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1BTK 解像度: 2.58→29.67 Å / Rfactor Rfree error: 0.008 / Data cutoff high absF: 1076225.33 / Data cutoff low absF: 0 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 0
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: FLAT MODEL / Bsol: 46.8175 Å2 / ksol: 0.353675 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 52.4 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.58→29.67 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.58→2.74 Å / Rfactor Rfree error: 0.031 / Total num. of bins used: 6
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj