| 登録情報 | データベース: PDB / ID: 2tcl
|
|---|
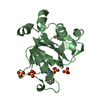
| タイトル | STRUCTURE OF THE CATALYTIC DOMAIN OF HUMAN FIBROBLAST COLLAGENASE COMPLEXED WITH AN INHIBITOR |
|---|
 要素 要素 | FIBROBLAST COLLAGENASE |
|---|
 キーワード キーワード | HYDROLASE (METALLOPROTEASE) |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
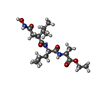
interstitial collagenase / cellular response to UV-A / Basigin interactions / Activation of Matrix Metalloproteinases / Collagen degradation / collagen catabolic process / extracellular matrix disassembly / Degradation of the extracellular matrix / extracellular matrix organization / extracellular matrix ...interstitial collagenase / cellular response to UV-A / Basigin interactions / Activation of Matrix Metalloproteinases / Collagen degradation / collagen catabolic process / extracellular matrix disassembly / Degradation of the extracellular matrix / extracellular matrix organization / extracellular matrix / positive regulation of protein-containing complex assembly / metalloendopeptidase activity / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / peptidase activity / Interleukin-4 and Interleukin-13 signaling / endopeptidase activity / serine-type endopeptidase activity / proteolysis / extracellular region / zinc ion binding類似検索 - 分子機能 Hemopexin, conserved site / Hemopexin domain signature. / Hemopexin-like domain / Peptidoglycan binding-like / Peptidase M10A, cysteine switch, zinc binding site / Matrixins cysteine switch. / Hemopexin-like repeats / Hemopexin-like domain superfamily / Hemopexin / Putative peptidoglycan binding domain ...Hemopexin, conserved site / Hemopexin domain signature. / Hemopexin-like domain / Peptidoglycan binding-like / Peptidase M10A, cysteine switch, zinc binding site / Matrixins cysteine switch. / Hemopexin-like repeats / Hemopexin-like domain superfamily / Hemopexin / Putative peptidoglycan binding domain / Hemopexin repeat profile. / Hemopexin-like repeats. / Peptidase M10A / Peptidase M10A, catalytic domain / Peptidase M10, metallopeptidase / Matrixin / PGBD-like superfamily / Peptidase, metallopeptidase / Zinc-dependent metalloprotease / Collagenase (Catalytic Domain) / Collagenase (Catalytic Domain) / Metallopeptidase, catalytic domain superfamily / Neutral zinc metallopeptidases, zinc-binding region signature. / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 Chem-RO4 / SAMARIUM (III) ION / Interstitial collagenase類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / 解像度: 2.2 Å X線回折 / 解像度: 2.2 Å |
|---|
 データ登録者 データ登録者 | Winkler, F.K. / Borkakoti, N. / D'Arcy, A. |
|---|
 引用 引用 |  ジャーナル: Nat.Struct.Biol. / 年: 1994 ジャーナル: Nat.Struct.Biol. / 年: 1994
タイトル: Structure of the catalytic domain of human fibroblast collagenase complexed with an inhibitor.
著者: Borkakoti, N. / Winkler, F.K. / Williams, D.H. / D'Arcy, A. / Broadhurst, M.J. / Brown, P.A. / Johnson, W.H. / Murray, E.J. |
|---|
| 履歴 | | 登録 | 1994年9月7日 | 処理サイト: BNL |
|---|
| 改定 1.0 | 1996年3月8日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年3月25日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2024年2月21日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Other
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_database_status / pdbx_struct_conn_angle / struct_conn / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.process_site / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr2_auth_comp_id / _pdbx_struct_conn_angle.ptnr2_auth_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr2_label_atom_id / _pdbx_struct_conn_angle.ptnr2_label_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 / 解像度: 2.2 Å
X線回折 / 解像度: 2.2 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Nat.Struct.Biol. / 年: 1994
ジャーナル: Nat.Struct.Biol. / 年: 1994 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2tcl.cif.gz
2tcl.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2tcl.ent.gz
pdb2tcl.ent.gz PDB形式
PDB形式 2tcl.json.gz
2tcl.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/tc/2tcl
https://data.pdbj.org/pub/pdb/validation_reports/tc/2tcl ftp://data.pdbj.org/pub/pdb/validation_reports/tc/2tcl
ftp://data.pdbj.org/pub/pdb/validation_reports/tc/2tcl リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 参照: UniProt: P03956
Homo sapiens (ヒト) / 参照: UniProt: P03956







 X線回折
X線回折 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj










