| 1 | 0.7 mM [U-15N] Fyn SH3 A39V/N53P/V55L, 0.2 mM EDTA, 0.05 % sodium azide, 50 mM potassium phosphate, 90% H2O/10% D2O | 90% H2O/10% D2O| 2 | 1.0 mM [U-15N; U-2H] Fyn SH3 A39V/N53P/V55L, 0.2 mM EDTA, 0.05 % sodium azide-7, 50 mM potassium phosphate-8, 90% H2O/10% D2O | 90% H2O/10% D2O| 3 | 0.8 mM [U-15N; U-2H] Fyn SH3 A39V/N53P/V55L, 0.2 mM EDTA-10, 0.05 % sodium azide, 50 mM potassium phosphate, 24 mg/ml Pf1 phage, 90% H2O/10% D2O | 90% H2O/10% D2O| 4 | 0.5 mM [U-15N; U-2H] Fyn SH3 A39V/N53P/V55L, 0.2 mM EDTA, 0.05 % sodium azide, 50 mM potassium phosphate, uncertain v/v PEG/hexanol, 90% H2O/10% D2O | 90% H2O/10% D2O| 5 | 1.2 mM [U-13C; U-15N; U-2H] Fyn SH3 A39V/N53P/V55L, 0.2 mM EDTA, 0.05 % sodium azide, 50 mM potassium phosphate, 90% H2O/10% D2O | 90% H2O/10% D2O| 6 | 0.8 mM [U-13C; U-15N; U-2H] Fyn SH3 A39V/N53P/V55L, 0.2 mM EDTA, 0.05 % sodium azide, 50 mM potassium phosphate, 36 mg/ml Pf1 phage, 90% H2O/10% D2O | 90% H2O/10% D2O| 7 | 1.0 mM [U-13C; U-15N; U-50% 2H] Fyn SH3 A39V/N53P/V55L, 0.2 mM EDTA, 0.05 % sodium azide, 50 mM potassium phosphate, 90% H2O/10% D2O | 90% H2O/10% D2O| 8 | 1.0 mM [U-13C; U-15N; U-50% 2H] Fyn SH3 A39V/N53P/V55L, 0.2 mM EDTA, 0.05 % sodium azide, 50 mM potassium phosphate, 100% D2O | 100% D2O| 9 | 1.0 mM [2'-13C glucose; U-15N] Fyn SH3 A39V/N53P/V55L, 0.2 mM EDTA, 0.05 % sodium azide, 50 mM potassium phosphate, 100% D2O | 100% D2O| 10 | 1.0 mM [1'-13C glucose; U-15N] Fyn SH3 A39V/N53P/V55L, 0.2 mM EDTA, 0.05 % sodium azide, 50 mM potassium phosphate, 90% H2O/10% D2O | 90% H2O/10% D2O| 11 | 1.2 mM [1'-13C glucose; U-15N] Fyn SH3 A39V/N53P/V55L, 0.2 mM EDTA, 0.05 % sodium azide, 50 mM potassium phosphate, 100% D2O | 100% D2O | | | | | | | | | | |
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 データ登録者
データ登録者 引用
引用 ジャーナル: Science / 年: 2012
ジャーナル: Science / 年: 2012 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2l2p.cif.gz
2l2p.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2l2p.ent.gz
pdb2l2p.ent.gz PDB形式
PDB形式 2l2p.json.gz
2l2p.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/l2/2l2p
https://data.pdbj.org/pub/pdb/validation_reports/l2/2l2p ftp://data.pdbj.org/pub/pdb/validation_reports/l2/2l2p
ftp://data.pdbj.org/pub/pdb/validation_reports/l2/2l2p リンク
リンク 集合体
集合体
 要素
要素

 試料調製
試料調製 ムービー
ムービー コントローラー
コントローラー





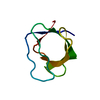









 PDBj
PDBj
 HSQC
HSQC