+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2kcx | ||||||
|---|---|---|---|---|---|---|---|
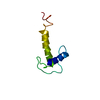
| タイトル | Solution NMR Structure of Kazal-1 Domain of Human Follistatin-related protein 3 (FSTL-3). Northeast Structural Genomics Target HR6186A. | ||||||
 要素 要素 | Follistatin-related protein 3 | ||||||
 キーワード キーワード | structural genomics / unknown function / Kazal-1 / Follistatin / Chromosomal rearrangement / Glycoprotein / Nucleus / Proto-oncogene / Secreted / PSI-2 / Protein Structure Initiative / Northeast Structural Genomics Consortium / NESG / NUCLEOTIDE-BINDING PROTEIN | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of transmembrane receptor protein serine/threonine kinase signaling pathway / Antagonism of Activin by Follistatin / positive regulation of cell-cell adhesion / regulation of BMP signaling pathway / activin binding / negative regulation of activin receptor signaling pathway / negative regulation of osteoclast differentiation / fibronectin binding / negative regulation of BMP signaling pathway / hematopoietic progenitor cell differentiation ...negative regulation of transmembrane receptor protein serine/threonine kinase signaling pathway / Antagonism of Activin by Follistatin / positive regulation of cell-cell adhesion / regulation of BMP signaling pathway / activin binding / negative regulation of activin receptor signaling pathway / negative regulation of osteoclast differentiation / fibronectin binding / negative regulation of BMP signaling pathway / hematopoietic progenitor cell differentiation / ossification / Post-translational protein phosphorylation / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / cell differentiation / endoplasmic reticulum lumen / regulation of transcription by RNA polymerase II / positive regulation of transcription by RNA polymerase II / extracellular space / extracellular region / nucleoplasm / nucleus 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 溶液NMR / torsion angle dynamics | ||||||
| Model details | lowest energy, model 1 | ||||||
 データ登録者 データ登録者 | Rossi, P. / Chiang, Y. / Anderson, S. / Montelione, G.T. / Northeast Structural Genomics Consortium (NESG) | ||||||
 引用 引用 |  ジャーナル: To be Published ジャーナル: To be Publishedタイトル: Solution NMR Structure of Kazal-1 Domain of Human Follistatin-related protein 3 (FSTL-3). Northeast Structural Genomics Target HR6186A. 著者: Rossi, P. / Chiang, Y. / Anderson, S. / Montelione, G.T. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2kcx.cif.gz 2kcx.cif.gz | 461.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2kcx.ent.gz pdb2kcx.ent.gz | 390.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2kcx.json.gz 2kcx.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2kcx_validation.pdf.gz 2kcx_validation.pdf.gz | 339.4 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2kcx_full_validation.pdf.gz 2kcx_full_validation.pdf.gz | 442.8 KB | 表示 | |
| XML形式データ |  2kcx_validation.xml.gz 2kcx_validation.xml.gz | 22.8 KB | 表示 | |
| CIF形式データ |  2kcx_validation.cif.gz 2kcx_validation.cif.gz | 38.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/kc/2kcx https://data.pdbj.org/pub/pdb/validation_reports/kc/2kcx ftp://data.pdbj.org/pub/pdb/validation_reports/kc/2kcx ftp://data.pdbj.org/pub/pdb/validation_reports/kc/2kcx | HTTPS FTP |
-関連構造データ
| 類似構造データ | |
|---|---|
| その他のデータベース |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質 | 分子量: 7981.164 Da / 分子数: 1 / 断片: Kazal-1 domain, residues 97-169 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: FSTL3, FLRG, UNQ674/PRO1308 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: FSTL3, FLRG, UNQ674/PRO1308 / 発現宿主:  |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 溶液NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
|
- 試料調製
試料調製
| 詳細 |
| ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試料 |
| ||||||||||||||||||||||||||||
| 試料状態 | イオン強度: 0.2 / pH: 6.5 / 圧: ambient / 温度: 298 K |
-NMR測定
| NMRスペクトロメーター | タイプ: Bruker Avance / 製造業者: Bruker / モデル: AVANCE / 磁場強度: 800 MHz |
|---|
- 解析
解析
| NMR software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法: torsion angle dynamics / ソフトェア番号: 1 詳細: MONOMER BY GEL FILTRATION CHROMATOGRAPHY/LIGHT SCATTERING AND BY NMR. T1/T2(CPMG) (MS) = 516.1/136.2, TAUC = 3.94(NS). CONSISTENT WITH MOLECULAR WEIGHT. STRUCTURE DETERMINED BY TRIPLE ...詳細: MONOMER BY GEL FILTRATION CHROMATOGRAPHY/LIGHT SCATTERING AND BY NMR. T1/T2(CPMG) (MS) = 516.1/136.2, TAUC = 3.94(NS). CONSISTENT WITH MOLECULAR WEIGHT. STRUCTURE DETERMINED BY TRIPLE RESONANCE NMR SPECTROSCOPY. NOESY ASSIGNMENTS BY CYANA2.1. 20 OF 100 STRUCTURES LOWEST TARGET FUNCTION SELECTED WITH CYANA-2.1. SELECTED MODELS ARE FURTHER REFINED USING CNS IN EXPLICIT WATER SHELL (NILGES PROTOCOL WITH PARAM19). ASSIGNMENT STATS (EXCLUDING C-TERM TAG): BACKBONE 98.10%, SIDECHAIN 88.50%, AROMATIC (SC) 75.00%. STRUCTURE BASED ON 912 NOE, 65 DIHE. MAX NOE VIOLATION: 0.19 A (1MODEL); MAX DIHE VIOLATION: 5.4 DEG. 6 TOTAL CLOSE CONTACTS PER 20 MODELS. STRUCTURE QUALITY FACTOR (PSVS 1.3): ORDERED RESIDUES RANGES: 4-9, 13-27, 33-34, 37-58, 61-69, 72-73 FOR [S(PHI)+S(PSI)] > 1.8. SECONDARY STRUCTURE - ALPHA HELICES: 50-60, BETA STRANDS: 13-18, 21-26, 46-47, 39-41, 66-69. RMSD 1.3 BACKBONE, 1.8 ALL HEAVY ATOMS. RAMA. DISTRIBUTION: 92.1/7.8/0.1/0.0. PROCHECK (PSI-PHI): -0.34/-1.02 (RAW/Z), PROCHECK (ALL): -0.33/-1.95 (RAW/Z), MOLPROBITY CLASH: 19.69/-1.85 (RAW/Z). RPF SCORES ALL ASSIGNED RESIDUES (FIT OF NOESY PEAKLISTS TO STRUCTURE): RECALL: 0.99, PRECISION: 0.85, F-MEASURE: 0.91, DP-SCORE: 0.82. | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 代表構造 | 選択基準: lowest energy | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: target function / 計算したコンフォーマーの数: 100 / 登録したコンフォーマーの数: 20 |
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj
 HSQC
HSQC