+ データを開く
データを開く
- 基本情報
基本情報
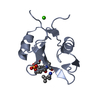
| 登録情報 | データベース: PDB / ID: 1zfp | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | GROWTH FACTOR RECEPTOR BINDING PROTEIN SH2 DOMAIN COMPLEXED WITH A PHOSPHOTYROSYL PENTAPEPTIDE | ||||||||||||
 要素 要素 |
| ||||||||||||
 キーワード キーワード | COMPLEX (SIGNAL TRANSDUCTION/PEPTIDE) / SIGNAL TRANSDUCTION / SH2 DOMAIN / PHOSPHOTYROSYL PEPTIDE / COMPLEX (SIGNAL TRANSDUCTION-PEPTIDE) / COMPLEX (SIGNAL TRANSDUCTION-PEPTIDE) complex | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / : / Regulation of T cell activation by CD28 family / : / Signaling by FGFR3 fusions in cancer / anatomical structure formation involved in morphogenesis / guanyl-nucleotide exchange factor adaptor activity / Grb2-EGFR complex / branching involved in labyrinthine layer morphogenesis / STAT5 Activation ...: / : / Regulation of T cell activation by CD28 family / : / Signaling by FGFR3 fusions in cancer / anatomical structure formation involved in morphogenesis / guanyl-nucleotide exchange factor adaptor activity / Grb2-EGFR complex / branching involved in labyrinthine layer morphogenesis / STAT5 Activation / Co-inhibition by BTLA / COP9 signalosome / neurotrophin TRKA receptor binding / Activated NTRK2 signals through PI3K / MET receptor recycling / transmembrane receptor protein tyrosine kinase adaptor activity / Signaling by cytosolic FGFR1 fusion mutants / Interleukin-15 signaling / MET activates PTPN11 / negative regulation of natural killer cell mediated cytotoxicity / MET activates RAP1 and RAC1 / vesicle membrane / Signaling by LTK / CD28 dependent Vav1 pathway / MET activates PI3K/AKT signaling / Signal regulatory protein family interactions / epidermal growth factor receptor binding / Regulation of KIT signaling / PI-3K cascade:FGFR3 / natural killer cell mediated cytotoxicity / STAT5 activation downstream of FLT3 ITD mutants / PI-3K cascade:FGFR2 / PI-3K cascade:FGFR4 / PI-3K cascade:FGFR1 / positive regulation of actin filament polymerization / endodermal cell differentiation / GRB2:SOS provides linkage to MAPK signaling for Integrins / RHOU GTPase cycle / regulation of MAPK cascade / RET signaling / PI3K events in ERBB2 signaling / Interleukin-3, Interleukin-5 and GM-CSF signaling / insulin receptor substrate binding / PI3K Cascade / signal transduction in response to DNA damage / SOS-mediated signalling / Activated NTRK3 signals through RAS / Activated NTRK2 signals through RAS / fibroblast growth factor receptor signaling pathway / Role of LAT2/NTAL/LAB on calcium mobilization / SHC1 events in ERBB4 signaling / Interleukin receptor SHC signaling / RHO GTPases Activate WASPs and WAVEs / Signalling to RAS / GAB1 signalosome / Signal attenuation / Activated NTRK2 signals through FRS2 and FRS3 / SHC-related events triggered by IGF1R / Schwann cell development / SHC-mediated cascade:FGFR3 / MET activates RAS signaling / SHC-mediated cascade:FGFR2 / Signaling by PDGFRA transmembrane, juxtamembrane and kinase domain mutants / Signaling by PDGFRA extracellular domain mutants / SHC-mediated cascade:FGFR4 / Erythropoietin activates RAS / SHC-mediated cascade:FGFR1 / Signaling by FGFR4 in disease / Signaling by CSF3 (G-CSF) / FRS-mediated FGFR3 signaling / ephrin receptor binding / Signaling by FLT3 ITD and TKD mutants / FRS-mediated FGFR2 signaling / FRS-mediated FGFR4 signaling / FRS-mediated FGFR1 signaling / Signaling by FGFR3 in disease / Tie2 Signaling / Signaling by FGFR2 in disease / phosphotyrosine residue binding / myelination / GRB2 events in EGFR signaling / SHC1 events in EGFR signaling / Signaling by FLT3 fusion proteins / FLT3 Signaling / Signaling by FGFR1 in disease / EGFR Transactivation by Gastrin / FCERI mediated Ca+2 mobilization / NCAM signaling for neurite out-growth / GRB2 events in ERBB2 signaling / Downstream signal transduction / Insulin receptor signalling cascade / insulin-like growth factor receptor signaling pathway / SHC1 events in ERBB2 signaling / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / Constitutive Signaling by Overexpressed ERBB2 / Signaling by phosphorylated juxtamembrane, extracellular and kinase domain KIT mutants / T cell activation / InlB-mediated entry of Listeria monocytogenes into host cell / cellular response to ionizing radiation / B cell receptor signaling pathway 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.8 Å 分子置換 / 解像度: 1.8 Å | ||||||||||||
 データ登録者 データ登録者 | Rahuel, J. | ||||||||||||
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 1998 ジャーナル: J.Mol.Biol. / 年: 1998タイトル: Structural basis for the high affinity of amino-aromatic SH2 phosphopeptide ligands. 著者: Rahuel, J. / Garcia-Echeverria, C. / Furet, P. / Strauss, A. / Caravatti, G. / Fretz, H. / Schoepfer, J. / Gay, B. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1zfp.cif.gz 1zfp.cif.gz | 38.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1zfp.ent.gz pdb1zfp.ent.gz | 25.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1zfp.json.gz 1zfp.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1zfp_validation.pdf.gz 1zfp_validation.pdf.gz | 376.4 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1zfp_full_validation.pdf.gz 1zfp_full_validation.pdf.gz | 375.8 KB | 表示 | |
| XML形式データ |  1zfp_validation.xml.gz 1zfp_validation.xml.gz | 4.1 KB | 表示 | |
| CIF形式データ |  1zfp_validation.cif.gz 1zfp_validation.cif.gz | 6.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/zf/1zfp https://data.pdbj.org/pub/pdb/validation_reports/zf/1zfp ftp://data.pdbj.org/pub/pdb/validation_reports/zf/1zfp ftp://data.pdbj.org/pub/pdb/validation_reports/zf/1zfp | HTTPS FTP |
-関連構造データ
| 関連構造データ |  1lcjS S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 5 | 
| ||||||||
| 単位格子 |
| ||||||||
| Components on special symmetry positions |
|
- 要素
要素
| #1: タンパク質 | 分子量: 11443.959 Da / 分子数: 1 / 断片: SH2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: THE PROTEIN WAS EXPRESSED AS A Homo sapiens (ヒト) / 遺伝子: THE PROTEIN WAS EXPRESSED AS A遺伝子 (発現宿主): THE PROTEIN WAS EXPRESSED AS A FUSION PROTEIN WITH GLUTATHIONE-S-TRANSFERASE (GST) AND CLEAVED USING FACTOR X 発現宿主:  |
|---|---|
| #2: タンパク質・ペプチド | 分子量: 862.800 Da / 分子数: 1 / 断片: 1067-1071 / 由来タイプ: 組換発現 |
| #3: 化合物 | ChemComp-ZN / |
| #4: 水 | ChemComp-HOH / |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.73 Å3/Da / 溶媒含有率: 55 % / 解説: THE MODEL WAS SUBSTANTIALLY TRUNCATED | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | pH: 7.5 / 詳細: pH 7.5 | |||||||||||||||||||||||||
| 結晶化 | *PLUS 手法: 蒸気拡散法 | |||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 293 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: ENRAF-NONIUS FR571 / 波長: 1.5418 回転陽極 / タイプ: ENRAF-NONIUS FR571 / 波長: 1.5418 |
| 検出器 | タイプ: ENRAF-NONIUS FAST / 検出器: DIFFRACTOMETER / 日付: 1994年10月21日 |
| 放射 | モノクロメーター: YES / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 1.8→30 Å / Num. obs: 12572 / % possible obs: 99 % / 冗長度: 5.6 % / Rmerge(I) obs: 0.093 / Net I/σ(I): 4.6 |
| 反射 シェル | 解像度: 1.8→1.85 Å / 冗長度: 4.2 % / Rmerge(I) obs: 0.44 / Mean I/σ(I) obs: 1.7 / % possible all: 98 |
| 反射 シェル | *PLUS % possible obs: 98 % |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 1LCJ (LCK-SH2) 解像度: 1.8→6 Å / σ(F): 0 /
| ||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.8→6 Å
| ||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: TNT / バージョン: 4-A / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS | ||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | ||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj


























