+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1zeg | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | STRUCTURE OF B28 ASP INSULIN IN COMPLEX WITH PHENOL | ||||||
 要素 要素 | (INSULIN) x 2 | ||||||
 キーワード キーワード | HORMONE / METABOLIC ROLE / CHEMICAL ACTIVITY / INSULIN MUTANT / CROSS-LINK / GLUCOSE METABOLISM / DIABETES | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of NAD(P)H oxidase activity / negative regulation of glycogen catabolic process / positive regulation of nitric oxide mediated signal transduction / negative regulation of fatty acid metabolic process / Signaling by Insulin receptor / negative regulation of feeding behavior / IRS activation / Insulin processing / regulation of protein secretion / positive regulation of peptide hormone secretion ...negative regulation of NAD(P)H oxidase activity / negative regulation of glycogen catabolic process / positive regulation of nitric oxide mediated signal transduction / negative regulation of fatty acid metabolic process / Signaling by Insulin receptor / negative regulation of feeding behavior / IRS activation / Insulin processing / regulation of protein secretion / positive regulation of peptide hormone secretion / positive regulation of respiratory burst / Regulation of gene expression in beta cells / negative regulation of acute inflammatory response / positive regulation of protein autophosphorylation / alpha-beta T cell activation / positive regulation of dendritic spine maintenance / Synthesis, secretion, and deacylation of Ghrelin / negative regulation of respiratory burst involved in inflammatory response / negative regulation of protein secretion / positive regulation of glycogen biosynthetic process / negative regulation of gluconeogenesis / Signal attenuation / fatty acid homeostasis / FOXO-mediated transcription of oxidative stress, metabolic and neuronal genes / positive regulation of insulin receptor signaling pathway / negative regulation of lipid catabolic process / regulation of protein localization to plasma membrane / positive regulation of lipid biosynthetic process / negative regulation of oxidative stress-induced intrinsic apoptotic signaling pathway / activation of protein kinase B activity / COPI-mediated anterograde transport / transport vesicle / nitric oxide-cGMP-mediated signaling / negative regulation of reactive oxygen species biosynthetic process / Insulin receptor recycling / insulin-like growth factor receptor binding / positive regulation of brown fat cell differentiation / NPAS4 regulates expression of target genes / neuron projection maintenance / endoplasmic reticulum-Golgi intermediate compartment membrane / positive regulation of nitric-oxide synthase activity / positive regulation of mitotic nuclear division / Insulin receptor signalling cascade / regulation of transmembrane transporter activity / positive regulation of glycolytic process / positive regulation of long-term synaptic potentiation / endosome lumen / positive regulation of cytokine production / acute-phase response / positive regulation of D-glucose import / positive regulation of protein secretion / positive regulation of cell differentiation / Regulation of insulin secretion / insulin receptor binding / wound healing / negative regulation of protein catabolic process / hormone activity / regulation of synaptic plasticity / positive regulation of neuron projection development / positive regulation of protein localization to nucleus / Golgi lumen / cognition / glucose metabolic process / vasodilation / insulin receptor signaling pathway / glucose homeostasis / cell-cell signaling / regulation of protein localization / PI5P, PP2A and IER3 Regulate PI3K/AKT Signaling / protease binding / positive regulation of cell growth / secretory granule lumen / positive regulation of canonical NF-kappaB signal transduction / positive regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction / positive regulation of MAPK cascade / positive regulation of cell migration / G protein-coupled receptor signaling pathway / Amyloid fiber formation / endoplasmic reticulum lumen / Golgi membrane / negative regulation of gene expression / positive regulation of cell population proliferation / positive regulation of gene expression / regulation of DNA-templated transcription / extracellular space / extracellular region / identical protein binding 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / 解像度: 1.6 Å X線回折 / 解像度: 1.6 Å | ||||||
 データ登録者 データ登録者 | Whittingham, J.L. / Edwards, E.J. / Antson, A.A. / Clarkson, J.M. / Dodson, G.G. | ||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 1998 ジャーナル: Biochemistry / 年: 1998タイトル: Interactions of phenol and m-cresol in the insulin hexamer, and their effect on the association properties of B28 pro --> Asp insulin analogues. 著者: Whittingham, J.L. / Edwards, D.J. / Antson, A.A. / Clarkson, J.M. / Dodson, G.G. #1:  ジャーナル: Structure / 年: 1995 ジャーナル: Structure / 年: 1995タイトル: Role of C-Terminal B-Chain Residues in Insulin Assembly: The Structure of Hexameric Lysb28Prob29-Human Insulin 著者: Ciszak, E. / Beals, J.M. / Frank, B.H. / Baker, J.C. / Carter, N.D. / Smith, G.D. #2:  ジャーナル: Biopolymers / 年: 1992 ジャーナル: Biopolymers / 年: 1992タイトル: The Structure of a Rhombohedral R6 Insulin Hexamer that Binds Phenol 著者: Smith, G.D. / Dodson, G.G. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1zeg.cif.gz 1zeg.cif.gz | 37.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1zeg.ent.gz pdb1zeg.ent.gz | 25.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1zeg.json.gz 1zeg.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ze/1zeg https://data.pdbj.org/pub/pdb/validation_reports/ze/1zeg ftp://data.pdbj.org/pub/pdb/validation_reports/ze/1zeg ftp://data.pdbj.org/pub/pdb/validation_reports/ze/1zeg | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 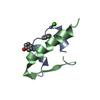
| ||||||||||||||||||||||||
| 2 | 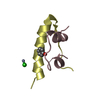
| ||||||||||||||||||||||||
| 3 | 
| ||||||||||||||||||||||||
| 4 |
| ||||||||||||||||||||||||
| 5 | 
| ||||||||||||||||||||||||
| 6 | 
| ||||||||||||||||||||||||
| 7 | 
| ||||||||||||||||||||||||
| 8 | 
| ||||||||||||||||||||||||
| 9 | 
| ||||||||||||||||||||||||
| 単位格子 |
| ||||||||||||||||||||||||
| Components on special symmetry positions |
|
- 要素
要素
-タンパク質・ペプチド , 2種, 4分子 ACBD
| #1: タンパク質・ペプチド | 分子量: 2383.698 Da / 分子数: 2 / 変異: CHAIN B, D, P28D / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 発現宿主: Homo sapiens (ヒト) / 発現宿主:  #2: タンパク質・ペプチド | 分子量: 3451.926 Da / 分子数: 2 / 変異: CHAIN B, D, P28D / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 発現宿主: Homo sapiens (ヒト) / 発現宿主:  |
|---|
-非ポリマー , 4種, 115分子 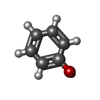






| #3: 化合物 | | #4: 化合物 | #5: 化合物 | #6: 水 | ChemComp-HOH / | |
|---|
-詳細
| Has protein modification | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 1.95 Å3/Da / 溶媒含有率: 40 % | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | 手法: batch method / pH: 6.5 詳細: BATCH METHOD, COMPOSITION OF CRYSTALLISATION SOLUTION 3.5 MG INSULIN + 0.5 ML 0.02M HCL + 0.05 ML 0.12M ZINC ACETATE + 0.25 ML 0.2M TRI-SODIUM CITRATE + 0.2 ML 2.5% (W/V) PHENOL IN ETHANOL + ...詳細: BATCH METHOD, COMPOSITION OF CRYSTALLISATION SOLUTION 3.5 MG INSULIN + 0.5 ML 0.02M HCL + 0.05 ML 0.12M ZINC ACETATE + 0.25 ML 0.2M TRI-SODIUM CITRATE + 0.2 ML 2.5% (W/V) PHENOL IN ETHANOL + 60 MG NACL, pH 6.5, batch method | |||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶 | *PLUS | |||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 温度: 50 ℃ / 手法: batch method / PH range low: 6.8 / PH range high: 6.2 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 120 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU RUH2R / 波長: 1.5418 回転陽極 / タイプ: RIGAKU RUH2R / 波長: 1.5418 |
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE |
| 放射 | 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 1.6→14.7 Å / Num. obs: 11469 / % possible obs: 98.9 % / 冗長度: 6.5 % / Biso Wilson estimate: 15 Å2 / Rmerge(I) obs: 0.023 |
| 反射 シェル | 解像度: 1.6→1.63 Å / Rmerge(I) obs: 0.038 / % possible all: 96.7 |
| 反射 | *PLUS Num. measured all: 74966 |
| 反射 シェル | *PLUS % possible obs: 97.4 % |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 開始モデル: B28ASP INSULIN WITH M-CRESOL DIMER 解像度: 1.6→14.7 Å / 交差検証法: FREE R / σ(F): 0
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 20.8 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.6→14.7 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: REFMAC / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS Num. reflection all: 11469 / Rfactor all: 0.145 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS |
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj




















