+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1thx | ||||||
|---|---|---|---|---|---|---|---|
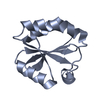
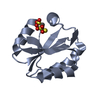
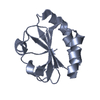
| タイトル | THIOREDOXIN-2 | ||||||
 要素 要素 | THIOREDOXIN | ||||||
 キーワード キーワード | ELECTRON TRANSPORT / OXIDO-REDUCTASE | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | ||||||
| 生物種 |  Nostoc sp. (バクテリア) Nostoc sp. (バクテリア) | ||||||
| 手法 |  X線回折 / 解像度: 1.6 Å X線回折 / 解像度: 1.6 Å | ||||||
 データ登録者 データ登録者 | Saarinen, M. / Gleason, F.K. / Eklund, H. | ||||||
 引用 引用 |  ジャーナル: Structure / 年: 1995 ジャーナル: Structure / 年: 1995タイトル: Crystal structure of thioredoxin-2 from Anabaena. 著者: Saarinen, M. / Gleason, F.K. / Eklund, H. #1:  ジャーナル: J.Bacteriol. / 年: 1992 ジャーナル: J.Bacteriol. / 年: 1992タイトル: Activities of Two Dissimilar Thioredoxins from the Cyanobacterium Anabaena Sp. Pcc 7120 著者: Gleason, F.K. #2:  ジャーナル: J.Bacteriol. / 年: 1989 ジャーナル: J.Bacteriol. / 年: 1989タイトル: Isolation, Sequence, and Expression in Escherichia Coli of an Unusual Thioredoxin Gene from the Cyanobacterium Anabaena Sp. Strain Pcc 7120 著者: Alam, J. / Curtis, S.E. / Gleason, F.K. / Gerami-Nejad, M. / Fuchs, J.A. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1thx.cif.gz 1thx.cif.gz | 41.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1thx.ent.gz pdb1thx.ent.gz | 28.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1thx.json.gz 1thx.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/th/1thx https://data.pdbj.org/pub/pdb/validation_reports/th/1thx ftp://data.pdbj.org/pub/pdb/validation_reports/th/1thx ftp://data.pdbj.org/pub/pdb/validation_reports/th/1thx | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| Atom site foot note | 1: CIS PROLINE - PRO 76 |
- 要素
要素
| #1: タンパク質 | 分子量: 12811.778 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Nostoc sp. (バクテリア) / 株: PCC 7120 / 遺伝子: TRXA / プラスミド: PAN673.2 / 遺伝子 (発現宿主): TRXA / 発現宿主: Nostoc sp. (バクテリア) / 株: PCC 7120 / 遺伝子: TRXA / プラスミド: PAN673.2 / 遺伝子 (発現宿主): TRXA / 発現宿主:  |
|---|---|
| #2: 水 | ChemComp-HOH / |
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 2 X線回折 / 使用した結晶の数: 2 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 1.89 Å3/Da / 溶媒含有率: 34.81 % | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | *PLUS 温度: 20 ℃ / 手法: 蒸気拡散法, シッティングドロップ法 | ||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射光源 | 波長: 1.5418 Å |
|---|---|
| 検出器 | タイプ: RIGAKU RAXIS IIC / 検出器: IMAGE PLATE / 日付: 1993年11月22日 |
| 放射 | 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | Num. obs: 10467 / % possible obs: 78.6 % / 冗長度: 3.3 % / Rmerge(I) obs: 0.035 |
| 反射 | *PLUS 最高解像度: 1.6 Å / 最低解像度: 34 Å / Observed criterion σ(I): 13.9 / Num. measured all: 34399 / Rmerge(I) obs: 0.035 |
| 反射 シェル | *PLUS 最高解像度: 1.6 Å / 最低解像度: 1.64 Å / % possible obs: 49.5 % |
- 解析
解析
| ソフトウェア |
| ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 1.6→7 Å / σ(F): 2 詳細: RESIDUES SER 1 AND LYS 2 COULD BE BUILT IN TWO ALTERNATE ORIENTATIONS ROTATED 180 DEGREES AROUND THE C-ALPHA - C BOND OF LYS 2. MOST OF THESE ATOMS HAVE GOOD ELECTRON DENSITY IN BOTH ...詳細: RESIDUES SER 1 AND LYS 2 COULD BE BUILT IN TWO ALTERNATE ORIENTATIONS ROTATED 180 DEGREES AROUND THE C-ALPHA - C BOND OF LYS 2. MOST OF THESE ATOMS HAVE GOOD ELECTRON DENSITY IN BOTH ORIENTATIONS, AND A POSITIVE DIFFERENCE FOURIER DENSITY SHOWS THE PRESENCE OF THE OTHER ORIENTATION, IN EITHER OF THE CASES.
| ||||||||||||||
| 原子変位パラメータ | Biso mean: 18.41 Å2 | ||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.6→7 Å
| ||||||||||||||
| ソフトウェア | *PLUS 名称:  X-PLOR / 分類: refinement X-PLOR / 分類: refinement | ||||||||||||||
| 精密化 | *PLUS Rfactor obs: 0.174 / Rfactor Rwork: 0.174 | ||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||
| 原子変位パラメータ | *PLUS | ||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj


