+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1o35 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Elaborate Manifold of Short Hydrogen Bond Arrays Mediating Binding of Active Site-Directed Serine Protease Inhibitors | ||||||
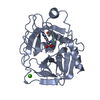
 要素 要素 | BETA-TRYPSIN | ||||||
 キーワード キーワード | HYDROLASE / serine protease / short hydrogen bond / inhibition mechanism / shift of pKa / trypsin / thrombin / urokinase / factor Xa | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報trypsin / serpin family protein binding / serine protease inhibitor complex / digestion / endopeptidase activity / serine-type endopeptidase activity / proteolysis / extracellular space / metal ion binding 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / X線回折 /  フーリエ合成 / 解像度: 1.41 Å フーリエ合成 / 解像度: 1.41 Å | ||||||
 データ登録者 データ登録者 | Katz, B.A. / Elrod, K. / Verner, E. / Mackman, R.L. / Luong, C. / Shrader, W.D. / Sendzik, M. / Spencer, J.R. / Sprengeler, P.A. / Kolesnikov, A. ...Katz, B.A. / Elrod, K. / Verner, E. / Mackman, R.L. / Luong, C. / Shrader, W.D. / Sendzik, M. / Spencer, J.R. / Sprengeler, P.A. / Kolesnikov, A. / Tai, V.W. / Hui, H.C. / Breitenbucher, J.G. / Allen, D. / Janc, J.W. | ||||||
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 2003 ジャーナル: J.Mol.Biol. / 年: 2003タイトル: Elaborate manifold of short hydrogen bond arrays mediating binding of active site-directed serine protease inhibitors. 著者: Katz, B.A. / Elrod, K. / Verner, E. / Mackman, R.L. / Luong, C. / Shrader, W.D. / Sendzik, M. / Spencer, J.R. / Sprengeler, P.A. / Kolesnikov, A. / Tai, V.W. / Hui, H.C. / Breitenbucher, J.G. ...著者: Katz, B.A. / Elrod, K. / Verner, E. / Mackman, R.L. / Luong, C. / Shrader, W.D. / Sendzik, M. / Spencer, J.R. / Sprengeler, P.A. / Kolesnikov, A. / Tai, V.W. / Hui, H.C. / Breitenbucher, J.G. / Allen, D. / Janc, J.W. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1o35.cif.gz 1o35.cif.gz | 111.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1o35.ent.gz pdb1o35.ent.gz | 87.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1o35.json.gz 1o35.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1o35_validation.pdf.gz 1o35_validation.pdf.gz | 699.2 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1o35_full_validation.pdf.gz 1o35_full_validation.pdf.gz | 701 KB | 表示 | |
| XML形式データ |  1o35_validation.xml.gz 1o35_validation.xml.gz | 14 KB | 表示 | |
| CIF形式データ |  1o35_validation.cif.gz 1o35_validation.cif.gz | 20.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/o3/1o35 https://data.pdbj.org/pub/pdb/validation_reports/o3/1o35 ftp://data.pdbj.org/pub/pdb/validation_reports/o3/1o35 ftp://data.pdbj.org/pub/pdb/validation_reports/o3/1o35 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  1o2gC  1o2hC  1o2iC  1o2jC  1o2kC  1o2lC  1o2mC  1o2nC  1o2oC  1o2pC  1o2qC  1o2rC  1o2sC  1o2tC  1o2uC  1o2vC  1o2wC  1o2xC  1o2yC  1o2zC  1o30C  1o31C  1o32C  1o33C  1o34C  1o36C  1o37C  1o38C  1o39C  1o3aC  1o3bC  1o3cC  1o3dC  1o3eC  1o3fC  1o3gC  1o3hC  1o3iC  1o3jC  1o3kC  1o3lC  1o3mC  1o3nC  1o3oC  1o3pC C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 23324.287 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|---|
| #2: 化合物 | ChemComp-CA / |
| #3: 化合物 | ChemComp-SO4 / |
| #4: 化合物 | ChemComp-802 / |
| #5: 水 | ChemComp-HOH / |
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3 Å3/Da / 溶媒含有率: 59.03 % |
|---|---|
| 結晶化 | 温度: 298 K / 手法: 蒸気拡散法 / pH: 8.1 詳細: magnesium sulfate soak at target pH (6.36). vapor diffusion at 298 K, pH 8.10 |
-データ収集
| 回折 | 平均測定温度: 298 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU RU200 / 波長: 1.5418 回転陽極 / タイプ: RIGAKU RU200 / 波長: 1.5418 |
| 検出器 | タイプ: RIGAKU RAXIS IV / 検出器: IMAGE PLATE / 日付: 2001年12月31日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 1.41→46.9 Å / Num. all: 54896 / Num. obs: 44476 / % possible obs: 81 % / Observed criterion σ(I): 0.8 / 冗長度: 2.4 % / Rmerge(I) obs: 0.061 / Net I/σ(I): 13.8 |
| 反射 シェル | 解像度: 1.41→1.47 Å / % possible obs: 43.2 % / Rmerge(I) obs: 0.263 / Mean I/σ(I) obs: 1.53 / Num. unique all: 6358 / % possible all: 43.2 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  フーリエ合成 / 解像度: 1.41→7 Å / 交差検証法: THROUGHOUT / σ(F): 1.8 / 立体化学のターゲット値: X-PLOR force field フーリエ合成 / 解像度: 1.41→7 Å / 交差検証法: THROUGHOUT / σ(F): 1.8 / 立体化学のターゲット値: X-PLOR force field詳細: Residues simultaneously refined in two or more conformations are: Val53, Leu66, Ser86, Ser110, Se113, Ser130, Lys159, Asp165, Ser170, Gln175, Ser195, Ser217, Ser236. Note that HOH383 makes ...詳細: Residues simultaneously refined in two or more conformations are: Val53, Leu66, Ser86, Ser110, Se113, Ser130, Lys159, Asp165, Ser170, Gln175, Ser195, Ser217, Ser236. Note that HOH383 makes short H-bonds with OgSer195 and O6' of the inhibitor His40 and HIS91 are MONOPROTONATED ON THE EPSILON NITROGEN. His57 is doubly protonated.
| ||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.41→7 Å
| ||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj









