| 登録情報 | データベース: PDB / ID: 1ljt
|
|---|
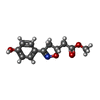
| タイトル | Crystal Structure of Macrophage Migration Inhibitory Factor complexed with (S,R)-3-(4-hydroxyphenyl)-4,5-dihydro-5-isoxazole-acetic acid methyl ester (ISO-1) |
|---|
 要素 要素 | Macrophage migration inhibitory factor |
|---|
 キーワード キーワード | IMMUNE SYSTEM / protein-inhibitor complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
positive regulation of prostaglandin secretion involved in immune response / positive regulation of myeloid leukocyte cytokine production involved in immune response / dopachrome isomerase activity / phenylpyruvate tautomerase / L-dopachrome isomerase / phenylpyruvate tautomerase activity / positive regulation of arachidonate secretion / cytokine receptor binding / negative regulation of myeloid cell apoptotic process / negative regulation of macrophage chemotaxis ...positive regulation of prostaglandin secretion involved in immune response / positive regulation of myeloid leukocyte cytokine production involved in immune response / dopachrome isomerase activity / phenylpyruvate tautomerase / L-dopachrome isomerase / phenylpyruvate tautomerase activity / positive regulation of arachidonate secretion / cytokine receptor binding / negative regulation of myeloid cell apoptotic process / negative regulation of macrophage chemotaxis / negative regulation of mature B cell apoptotic process / carboxylic acid metabolic process / positive regulation of lipopolysaccharide-mediated signaling pathway / positive regulation of chemokine (C-X-C motif) ligand 2 production / prostaglandin biosynthetic process / negative regulation of protein metabolic process / regulation of macrophage activation / negative regulation of intrinsic apoptotic signaling pathway in response to DNA damage by p53 class mediator / chemoattractant activity / protein homotrimerization / negative regulation of DNA damage response, signal transduction by p53 class mediator / positive regulation of cAMP/PKA signal transduction / negative regulation of cellular senescence / positive regulation of phosphorylation / positive regulation of B cell proliferation / Gene and protein expression by JAK-STAT signaling after Interleukin-12 stimulation / negative regulation of cell migration / positive regulation of cytokine production / cytokine activity / Cell surface interactions at the vascular wall / DNA damage response, signal transduction by p53 class mediator / positive regulation of fibroblast proliferation / positive regulation of tumor necrosis factor production / cellular senescence / protease binding / secretory granule lumen / vesicle / ficolin-1-rich granule lumen / cell surface receptor signaling pathway / positive regulation of ERK1 and ERK2 cascade / inflammatory response / negative regulation of gene expression / innate immune response / positive regulation of cell population proliferation / Neutrophil degranulation / negative regulation of apoptotic process / cell surface / extracellular space / extracellular exosome / extracellular region / nucleoplasm / identical protein binding / plasma membrane / cytosol / cytoplasm類似検索 - 分子機能 Macrophage migration inhibitory factor, conserved site / Macrophage migration inhibitory factor family signature. / Macrophage migration inhibitory factor / Macrophage migration inhibitory factor (MIF) / Macrophage Migration Inhibitory Factor / Macrophage Migration Inhibitory Factor / Tautomerase/MIF superfamily / 2-Layer Sandwich / Alpha Beta類似検索 - ドメイン・相同性 Chem-HDI / Macrophage migration inhibitory factor類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  フーリエ合成 / 解像度: 2 Å フーリエ合成 / 解像度: 2 Å |
|---|
 データ登録者 データ登録者 | Lubetsky, J.B. / Dios, A. / Han, J. / Aljabari, B. / Ruzsicska, B. / Mitchell, R. / Lolis, E. / Al-Abed, Y. |
|---|
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2002 ジャーナル: J.Biol.Chem. / 年: 2002
タイトル: The Tautomerase Active Site of Macrophage Migration Inhibitory factor is a Potential Target for Discovery of Novel Anti-inflammatory Agents
著者: Lubetsky, J.B. / Dios, A. / Han, J. / Aljabari, B. / Ruzsicska, B. / Mitchell, R. / Lolis, E. / Al-Abed, Y. |
|---|
| 履歴 | | 登録 | 2002年4月22日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2002年11月27日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年4月28日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2024年2月14日 | Group: Data collection / Database references / Derived calculations
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  フーリエ合成 / 解像度: 2 Å
フーリエ合成 / 解像度: 2 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Biol.Chem. / 年: 2002
ジャーナル: J.Biol.Chem. / 年: 2002 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1ljt.cif.gz
1ljt.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1ljt.ent.gz
pdb1ljt.ent.gz PDB形式
PDB形式 1ljt.json.gz
1ljt.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1ljt_validation.pdf.gz
1ljt_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1ljt_full_validation.pdf.gz
1ljt_full_validation.pdf.gz 1ljt_validation.xml.gz
1ljt_validation.xml.gz 1ljt_validation.cif.gz
1ljt_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/lj/1ljt
https://data.pdbj.org/pub/pdb/validation_reports/lj/1ljt ftp://data.pdbj.org/pub/pdb/validation_reports/lj/1ljt
ftp://data.pdbj.org/pub/pdb/validation_reports/lj/1ljt リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / プラスミド: pet11b / 生物種 (発現宿主): Escherichia coli / 発現宿主:
Homo sapiens (ヒト) / プラスミド: pet11b / 生物種 (発現宿主): Escherichia coli / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: RIGAKU RU200 / 波長: 1.54 Å
回転陽極 / タイプ: RIGAKU RU200 / 波長: 1.54 Å 解析
解析 フーリエ合成 / 解像度: 2→20 Å / 交差検証法: THROUGHOUT / σ(F): 2 / 立体化学のターゲット値: Engh & Huber
フーリエ合成 / 解像度: 2→20 Å / 交差検証法: THROUGHOUT / σ(F): 2 / 立体化学のターゲット値: Engh & Huber ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj