+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 1kft | ||||||
|---|---|---|---|---|---|---|---|
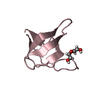
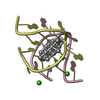
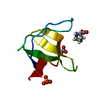
| Title | Solution Structure of the C-Terminal domain of UvrC from E-coli | ||||||
 Components Components | Excinuclease ABC subunit C | ||||||
 Keywords Keywords | DNA BINDING PROTEIN / helix-hairpin-helix / HhH domain / DNA-binding domain | ||||||
| Function / homology |  Function and homology information Function and homology informationexcinuclease ABC activity / excinuclease repair complex / SOS response / nucleotide-excision repair / response to radiation / DNA damage response / DNA binding / cytoplasm Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method | SOLUTION NMR / A simulated annealing protocol in Cartesian space was used. Final refinement was done with explicit water. | ||||||
 Authors Authors | Singh, S. / Folkers, G.E. / Bonvin, A.M.J.J. / Boelens, R. / Wechselberger, R. / Niztayev, A. / Kaptein, R. | ||||||
 Citation Citation |  Journal: EMBO J. / Year: 2002 Journal: EMBO J. / Year: 2002Title: Solution structure and DNA-binding properties of the C-terminal domain of UvrC from E.coli Authors: Singh, S. / Folkers, G.E. / Bonvin, A.M.J.J. / Boelens, R. / Wechselberger, R. / Niztayev, A. / Kaptein, R. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  1kft.cif.gz 1kft.cif.gz | 392.3 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb1kft.ent.gz pdb1kft.ent.gz | 330.6 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  1kft.json.gz 1kft.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Summary document |  1kft_validation.pdf.gz 1kft_validation.pdf.gz | 349.5 KB | Display |  wwPDB validaton report wwPDB validaton report |
|---|---|---|---|---|
| Full document |  1kft_full_validation.pdf.gz 1kft_full_validation.pdf.gz | 545.5 KB | Display | |
| Data in XML |  1kft_validation.xml.gz 1kft_validation.xml.gz | 49.8 KB | Display | |
| Data in CIF |  1kft_validation.cif.gz 1kft_validation.cif.gz | 73.8 KB | Display | |
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/kf/1kft https://data.pdbj.org/pub/pdb/validation_reports/kf/1kft ftp://data.pdbj.org/pub/pdb/validation_reports/kf/1kft ftp://data.pdbj.org/pub/pdb/validation_reports/kf/1kft | HTTPS FTP |
-Related structure data
| Similar structure data |
|---|
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR ensembles |
|
- Components
Components
| #1: Protein | Mass: 8579.860 Da / Num. of mol.: 1 / Fragment: HhH domain(C-Terminal Domain) Source method: isolated from a genetically manipulated source Source: (gene. exp.)   |
|---|
-Experimental details
-Experiment
| Experiment | Method: SOLUTION NMR | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR experiment |
|
- Sample preparation
Sample preparation
| Details |
| |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sample conditions |
| |||||||||||||||
| Crystal grow | *PLUS Method: other / Details: NMR |
-NMR measurement
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Radiation wavelength | Relative weight: 1 | ||||||||||||||||||||
| NMR spectrometer |
|
- Processing
Processing
| NMR software |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method: A simulated annealing protocol in Cartesian space was used. Final refinement was done with explicit water. Software ordinal: 1 Details: Calculation was done on the basis of 1326 unambiguous and 60 ambiguous distance restraints with the inclusion of 68 dihedral angle constraints. | ||||||||||||||||||||||||
| NMR representative | Selection criteria: fewest violations,lowest energy | ||||||||||||||||||||||||
| NMR ensemble | Conformer selection criteria: no NOE distance violations > 0.5A and lowest energies after refining the best 50 of the initial 200 in explicit water Conformers calculated total number: 200 / Conformers submitted total number: 22 |
 Movie
Movie Controller
Controller








 PDBj
PDBj





 NMRPipe
NMRPipe