| 登録情報 | データベース: PDB / ID: 1fna
|
|---|
| タイトル | CRYSTAL STRUCTURE OF THE TENTH TYPE III CELL ADHESION MODULE OF HUMAN FIBRONECTIN |
|---|
 要素 要素 | FIBRONECTIN CELL-ADHESION MODULE TYPE III-10 |
|---|
 キーワード キーワード | CELL ADHESION PROTEIN |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
negative regulation of monocyte activation / negative regulation of transforming growth factor beta production / Extracellular matrix organization / positive regulation of substrate-dependent cell migration, cell attachment to substrate / Fibronectin matrix formation / calcium-independent cell-matrix adhesion / neural crest cell migration involved in autonomic nervous system development / fibrinogen complex / peptide cross-linking / integrin activation ...negative regulation of monocyte activation / negative regulation of transforming growth factor beta production / Extracellular matrix organization / positive regulation of substrate-dependent cell migration, cell attachment to substrate / Fibronectin matrix formation / calcium-independent cell-matrix adhesion / neural crest cell migration involved in autonomic nervous system development / fibrinogen complex / peptide cross-linking / integrin activation / ALK mutants bind TKIs / cell-substrate junction assembly / regulation of protein phosphorylation / proteoglycan binding / biological process involved in interaction with symbiont / extracellular matrix structural constituent / Molecules associated with elastic fibres / MET activates PTK2 signaling / peptidase activator activity / Syndecan interactions / p130Cas linkage to MAPK signaling for integrins / response to muscle activity / endodermal cell differentiation / endoplasmic reticulum-Golgi intermediate compartment / GRB2:SOS provides linkage to MAPK signaling for Integrins / basement membrane / Non-integrin membrane-ECM interactions / ECM proteoglycans / Integrin cell surface interactions / endothelial cell migration / regulation of ERK1 and ERK2 cascade / positive regulation of axon extension / collagen binding / Degradation of the extracellular matrix / Integrin signaling / extracellular matrix / substrate adhesion-dependent cell spreading / platelet alpha granule lumen / cell-matrix adhesion / Turbulent (oscillatory, disturbed) flow shear stress activates signaling by PIEZO1 and integrins in endothelial cells / integrin-mediated signaling pathway / acute-phase response / Cell surface interactions at the vascular wall / Post-translational protein phosphorylation / wound healing / Signaling by high-kinase activity BRAF mutants / MAP2K and MAPK activation / response to wounding / integrin binding / Signaling by ALK fusions and activated point mutants / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / positive regulation of fibroblast proliferation / Signaling by RAF1 mutants / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / Signaling by BRAF and RAF1 fusions / GPER1 signaling / Platelet degranulation / nervous system development / regulation of cell shape / heparin binding / : / heart development / protease binding / blood microparticle / angiogenesis / Interleukin-4 and Interleukin-13 signaling / positive regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction / cell adhesion / apical plasma membrane / receptor ligand activity / endoplasmic reticulum lumen / signaling receptor binding / positive regulation of cell population proliferation / positive regulation of gene expression / extracellular space / extracellular exosome / extracellular region / identical protein binding / plasma membrane類似検索 - 分子機能 Fibronectin type I domain / Fibronectin, type I / Fibronectin type-I domain signature. / Fibronectin type-I domain profile. / Fibronectin type 1 domain / : / Fibronectin type II domain / Fibronectin type II domain superfamily / Fibronectin type II domain / Fibronectin type-II collagen-binding domain signature. ...Fibronectin type I domain / Fibronectin, type I / Fibronectin type-I domain signature. / Fibronectin type-I domain profile. / Fibronectin type 1 domain / : / Fibronectin type II domain / Fibronectin type II domain superfamily / Fibronectin type II domain / Fibronectin type-II collagen-binding domain signature. / Fibronectin type-II collagen-binding domain profile. / Fibronectin type 2 domain / Kringle-like fold / Fibronectin type III domain / EGF-like domain signature 1. / Fibronectin type 3 domain / Fibronectin type-III domain profile. / Fibronectin type III / Fibronectin type III superfamily / Immunoglobulin-like fold / Immunoglobulins / Immunoglobulin-like / Sandwich / Mainly Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / 解像度: 1.8 Å X線回折 / 解像度: 1.8 Å |
|---|
 データ登録者 データ登録者 | Dickinson, C.D. / Veerapandian, B. / Ely, K.R. |
|---|
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 1994 ジャーナル: J.Mol.Biol. / 年: 1994
タイトル: Crystal structure of the tenth type III cell adhesion module of human fibronectin.
著者: Dickinson, C.D. / Veerapandian, B. / Dai, X.P. / Hamlin, R.C. / Xuong, N.H. / Ruoslahti, E. / Ely, K.R. |
|---|
| 履歴 | | 登録 | 1994年1月11日 | 処理サイト: BNL |
|---|
| 改定 1.0 | 1994年4月30日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年3月24日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2024年2月7日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Other
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_database_status / struct_sheet
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.process_site / _struct_sheet.number_strands |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 / 解像度: 1.8 Å
X線回折 / 解像度: 1.8 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Mol.Biol. / 年: 1994
ジャーナル: J.Mol.Biol. / 年: 1994 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1fna.cif.gz
1fna.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1fna.ent.gz
pdb1fna.ent.gz PDB形式
PDB形式 1fna.json.gz
1fna.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1fna_validation.pdf.gz
1fna_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1fna_full_validation.pdf.gz
1fna_full_validation.pdf.gz 1fna_validation.xml.gz
1fna_validation.xml.gz 1fna_validation.cif.gz
1fna_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/fn/1fna
https://data.pdbj.org/pub/pdb/validation_reports/fn/1fna ftp://data.pdbj.org/pub/pdb/validation_reports/fn/1fna
ftp://data.pdbj.org/pub/pdb/validation_reports/fn/1fna リンク
リンク 集合体
集合体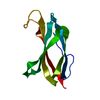
 要素
要素 Homo sapiens (ヒト) / 参照: UniProt: P02751
Homo sapiens (ヒト) / 参照: UniProt: P02751 X線回折
X線回折 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj
















