+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1cxk | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
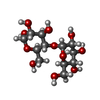
| タイトル | COMPLEX BETWEEN A MALTONONAOSE SUBSTRATE AND BACILLUS CIRCULANS STRAIN 251 CGTASE E257Q/D229N | |||||||||
 要素 要素 | PROTEIN (CYCLODEXTRIN-GLYCOSYLTRANSFERASE) | |||||||||
 キーワード キーワード | TRANSFERASE / GLYCOSYL HYDROLASE FAMILY 13 / ALPHA-AMYLASE FAMILY / SUBSTRATE COMPLEX / MALTONONAOSE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cyclomaltodextrin glucanotransferase / cyclomaltodextrin glucanotransferase activity / starch binding / alpha-amylase activity / carbohydrate metabolic process / extracellular region / metal ion binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Bacillus circulans (バクテリア) Bacillus circulans (バクテリア) | |||||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.09 Å 分子置換 / 解像度: 2.09 Å | |||||||||
 データ登録者 データ登録者 | Uitdehaag, J.C.M. / Kalk, K.H. / Dijkstra, B.W. | |||||||||
 引用 引用 |  ジャーナル: Nat.Struct.Biol. / 年: 1999 ジャーナル: Nat.Struct.Biol. / 年: 1999タイトル: X-ray structures along the reaction pathway of cyclodextrin glycosyltransferase elucidate catalysis in the alpha-amylase family. 著者: Uitdehaag, J.C. / Mosi, R. / Kalk, K.H. / van der Veen, B.A. / Dijkhuizen, L. / Withers, S.G. / Dijkstra, B.W. #1: ジャーナル: Biochemistry / 年: 1998 タイトル: Reassessment of acarbose as a transition state analogue inhibitor of cyclodextrin glycosyltransferase. 著者: Mosi, R. / Sham, H. / Uitdehaag, J.C. / Ruiterkamp, R. / Dijkstra, B.W. / Withers, S.G. #2:  ジャーナル: Biochemistry / 年: 1996 ジャーナル: Biochemistry / 年: 1996タイトル: Structure of cyclodextrin glycosyltransferase complexed with a maltononaose inhibitor at 2.6 angstrom resolution. Implications for product specificity. 著者: Strokopytov, B. / Knegtel, R.M. / Penninga, D. / Rozeboom, H.J. / Kalk, K.H. / Dijkhuizen, L. / Dijkstra, B.W. #3:  ジャーナル: J.Biol.Chem. / 年: 1995 ジャーナル: J.Biol.Chem. / 年: 1995タイトル: Crystallographic studies of the interaction of cyclodextrin glycosyltransferase from Bacillus circulans strain 251 with natural substrates and products. 著者: Knegtel, R.M. / Strokopytov, B. / Penninga, D. / Faber, O.G. / Rozeboom, H.J. / Kalk, K.H. / Dijkhuizen, L. / Dijkstra, B.W. #4:  ジャーナル: J.Mol.Biol. / 年: 1994 ジャーナル: J.Mol.Biol. / 年: 1994タイトル: Nucleotide sequence and X-ray structure of cyclodextrin glycosyltransferase from Bacillus circulans strain 251 in a maltose-dependent crystal form. 著者: Lawson, C.L. / van Montfort, R. / Strokopytov, B. / Rozeboom, H.J. / Kalk, K.H. / de Vries, G.E. / Penninga, D. / Dijkhuizen, L. / Dijkstra, B.W. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1cxk.cif.gz 1cxk.cif.gz | 165.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1cxk.ent.gz pdb1cxk.ent.gz | 128.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1cxk.json.gz 1cxk.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1cxk_validation.pdf.gz 1cxk_validation.pdf.gz | 600.7 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1cxk_full_validation.pdf.gz 1cxk_full_validation.pdf.gz | 613.2 KB | 表示 | |
| XML形式データ |  1cxk_validation.xml.gz 1cxk_validation.xml.gz | 16.2 KB | 表示 | |
| CIF形式データ |  1cxk_validation.cif.gz 1cxk_validation.cif.gz | 28 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/cx/1cxk https://data.pdbj.org/pub/pdb/validation_reports/cx/1cxk ftp://data.pdbj.org/pub/pdb/validation_reports/cx/1cxk ftp://data.pdbj.org/pub/pdb/validation_reports/cx/1cxk | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 1分子 A
| #1: タンパク質 | 分子量: 74573.516 Da / 分子数: 1 / 変異: E257Q, D229N / 由来タイプ: 組換発現 / 由来: (組換発現)  Bacillus circulans (バクテリア) / 株: 251 / 解説: MUTANTS WERE CONSTRUCTED IN ECOLI STRAIN MC1061 / プラスミド: PDP66S / 遺伝子 (発現宿主): CGT / 発現宿主: Bacillus circulans (バクテリア) / 株: 251 / 解説: MUTANTS WERE CONSTRUCTED IN ECOLI STRAIN MC1061 / プラスミド: PDP66S / 遺伝子 (発現宿主): CGT / 発現宿主:  参照: UniProt: P43379, cyclomaltodextrin glucanotransferase |
|---|
-糖 , 3種, 4分子
| #2: 多糖 | alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose / alpha-maltose |
|---|---|
| #3: 多糖 | alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose-(1-4)-alpha-D- ...alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose |
| #4: 多糖 |
-非ポリマー , 2種, 635分子 


| #5: 化合物 | | #6: 水 | ChemComp-HOH / | |
|---|
-詳細
| Has protein modification | Y |
|---|---|
| 非ポリマーの詳細 | CA: RESIDUES 688 AND 689 ARE CALCIUM IONS. GLC: THE GLC O1 ATOM IS CONNECTED TO THE C4 ATOM OF THE ...CA: RESIDUES 688 AND 689 ARE CALCIUM IONS. GLC: THE GLC O1 ATOM IS CONNECTED TO THE C4 ATOM OF THE PREVIOUS RESIDUE VIA AN ALPHA(1->4) GLYCOSIDIC |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.92 Å3/Da / 溶媒含有率: 61 % 解説: STEREOCHEMICAL RESTRAINTS ON SUGAR IN SUBSITE -1 WERE 10X RELAXED COMPARED TO OTHER SUGARS | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | pH: 10.3 / 詳細: pH 10.30 | ||||||||||||||||||||||||||||||
| 結晶化 | *PLUS pH: 5.5 / 手法: 蒸気拡散法 | ||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 120 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: ELLIOTT GX-21 / 波長: 1.5418 回転陽極 / タイプ: ELLIOTT GX-21 / 波長: 1.5418 |
| 検出器 | タイプ: ENRAF-NONIUS FAST / 検出器: DIFFRACTOMETER / 日付: 1996年1月1日 |
| 放射 | モノクロメーター: GRAPHITE / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 2.09→22.92 Å / Num. obs: 45159 / % possible obs: 84.9 % / Observed criterion σ(I): 3 / 冗長度: 4.6 % / Biso Wilson estimate: 13.65 Å2 / Rmerge(I) obs: 0.067 |
| 反射 シェル | 解像度: 2.09→2.16 Å / 冗長度: 1.3 % / Rmerge(I) obs: 0.16 / % possible all: 27.6 |
| 反射 | *PLUS % possible obs: 84.9 % |
| 反射 シェル | *PLUS % possible obs: 27.6 % |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 1CXI 解像度: 2.09→8 Å / Isotropic thermal model: TNT BCORREL / 交差検証法: RFREE / σ(F): 0 / 立体化学のターゲット値: TNT PROTGEO
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: BABINET SCALING / Bsol: 206.4 Å2 / ksol: 0.737 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.09→8 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: TNT / バージョン: 5E / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS Biso mean: 13.7 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj