+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1c2i | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | RECRUITING ZINC TO MEDIATE POTENT, SPECIFIC INHIBITION OF SERINE PROTEASES | ||||||
 要素 要素 | TRYPSIN | ||||||
 キーワード キーワード | HYDROLASE/HYDROLASE INHIBITOR / ZN(II)-MEDIATED SERINE PROTEASE INHIBITORS / PH DEPENDENCE / ZN(II) AFFINITY STUCTURE-BASED DRUG DESIGN / SERINE PROTEASE/INHIBITOR / HYDROLASE-HYDROLASE INHIBITOR COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報trypsin / serpin family protein binding / serine protease inhibitor complex / digestion / endopeptidase activity / serine-type endopeptidase activity / proteolysis / extracellular space / metal ion binding 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / DIFFERENCE FOURIER PLUS REFINEMENT / 解像度: 1.47 Å X線回折 / DIFFERENCE FOURIER PLUS REFINEMENT / 解像度: 1.47 Å | ||||||
 データ登録者 データ登録者 | Katz, B.A. / Luong, C. | ||||||
 引用 引用 |  ジャーナル: Nature / 年: 1998 ジャーナル: Nature / 年: 1998タイトル: Design of potent selective zinc-mediated serine protease inhibitors. 著者: Katz, B.A. / Clark, J.M. / Finer-Moore, J.S. / Jenkins, T.E. / Johnson, C.R. / Ross, M.J. / Luong, C. / Moore, W.R. / Stroud, R.M. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1c2i.cif.gz 1c2i.cif.gz | 107.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1c2i.ent.gz pdb1c2i.ent.gz | 84.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1c2i.json.gz 1c2i.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1c2i_validation.pdf.gz 1c2i_validation.pdf.gz | 692.6 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1c2i_full_validation.pdf.gz 1c2i_full_validation.pdf.gz | 696.6 KB | 表示 | |
| XML形式データ |  1c2i_validation.xml.gz 1c2i_validation.xml.gz | 13.8 KB | 表示 | |
| CIF形式データ |  1c2i_validation.cif.gz 1c2i_validation.cif.gz | 19.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/c2/1c2i https://data.pdbj.org/pub/pdb/validation_reports/c2/1c2i ftp://data.pdbj.org/pub/pdb/validation_reports/c2/1c2i ftp://data.pdbj.org/pub/pdb/validation_reports/c2/1c2i | HTTPS FTP |
-関連構造データ
| 関連構造データ |  1c1nC  1c1oC  1c1pC  1c1qC  1c1rC  1c1tC  1c1uC  1c1vC  1c1wC  1c2dC  1c2eC  1c2fC  1c2gC  1c2hC  1c2jC  1c2kC  1c2lC  1c2mC  1xufC  1xugC  1xuhC  1xuiC  1xujC  1xukC C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| Components on special symmetry positions |
|
- 要素
要素
-タンパク質 , 1種, 1分子 A
| #1: タンパク質 | 分子量: 23324.287 Da / 分子数: 1 / 由来タイプ: 天然 詳細: COMPLEXED WITH BIS(5-AMIDINO-2-BENZIMIDAZOLYL)METHANE KETONE 由来: (天然)  |
|---|
-非ポリマー , 6種, 203分子 


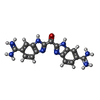







| #2: 化合物 | ChemComp-CA / | ||||||
|---|---|---|---|---|---|---|---|
| #3: 化合物 | ChemComp-CL / | ||||||
| #4: 化合物 | | #5: 化合物 | ChemComp-BAK / | #6: 化合物 | ChemComp-DMS / | #7: 水 | ChemComp-HOH / | |
-詳細
| 構成要素の詳細 | HIS91 IS MONOPROTONATED ON THE EPSILON NITROGEN. HIS57 IS MONOPROTONATED ON THE DELTA NITROGEN. ...HIS91 IS MONOPROTON |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.05 Å3/Da / 溶媒含有率: 18 % |
|---|---|
| 結晶化 | pH: 5.5 詳細: BATCH, 1.51 M MGSO4 . 7 H2O, 0.59 MM TRYPSIN, 1.0 MM ZN(II) 5.0 % DMSO: CRYSTALLIZATION SOLUTION WAS SATURATED IN KETO-BABIM. CRYSTAL WAS TRANSFERRED TO SYNTHETIC MOTHER LIQUOR CONTAINING 46 ...詳細: BATCH, 1.51 M MGSO4 . 7 H2O, 0.59 MM TRYPSIN, 1.0 MM ZN(II) 5.0 % DMSO: CRYSTALLIZATION SOLUTION WAS SATURATED IN KETO-BABIM. CRYSTAL WAS TRANSFERRED TO SYNTHETIC MOTHER LIQUOR CONTAINING 46 MM ZN(II), PH 5.50 AND SOAKED FOR SEVERAL DAYS WITH SEVERAL REPLACEMENTS OF SOAKING SOLUTIONS. THE SOLUTION WAS SATURATED IN KETO-BABIM AND CONTAINED 2.0 % DMSO TO INCREASE INHIBITOR SOLUBILITY. |
| 結晶化 | *PLUS 手法: unknown |
-データ収集
| 回折 | 平均測定温度: 298 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / 波長: 1.5418 回転陽極 / 波長: 1.5418 |
| 検出器 | タイプ: RIGAKU RAXIS IV++ / 検出器: IMAGE PLATE / 日付: 1997年2月25日 / 詳細: MSC MIRRORS |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 1.4→54.8 Å / Num. obs: 27202 / % possible obs: 80 % / Observed criterion σ(I): 1 / 冗長度: 3.2 % / Rmerge(I) obs: 0.071 / Net I/σ(I): 12.7 |
| 反射 シェル | 解像度: 1.47→1.54 Å / Rmerge(I) obs: 0.225 / Mean I/σ(I) obs: 2 / % possible all: 34.4 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法: DIFFERENCE FOURIER PLUS REFINEMENT / 解像度: 1.47→7.5 Å / 交差検証法: X-PLOR / σ(F): 2 詳細: BULK SOLVENT TERMS INCLUDED IN FOB FILE CREATED WITH STANDARD X-PLOR SCRIPT.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.47→7.5 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.47→1.54 Å / Total num. of bins used: 8
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
|
 ムービー
ムービー コントローラー
コントローラー






















 PDBj
PDBj






