+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | structure of human urea transport protein slc14A1 with urea | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | human urea transport protein slc14A1 / TRANSPORT PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報urea channel activity / water transmembrane transporter activity / urea transport / : / urea transmembrane transporter activity / urea transmembrane transport / establishment of localization in cell / transmembrane transport / basolateral plasma membrane / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.75 Å | |||||||||
 データ登録者 データ登録者 | He J / Wang F / Zhong C / Zhang P / Liu Z | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: J Biol Chem / 年: 2025 ジャーナル: J Biol Chem / 年: 2025タイトル: Structural basis of the bifunctionality of Marinobacter salinexigens ZYF650 glucosylglycerol phosphorylase in glucosylglycerol catabolism. 著者: Di Lu / Keke Zhang / Chen Cheng / Danni Wu / Lei Yin / Quan Luo / Meiyun Shi / Honglei Ma / Xuefeng Lu /  要旨: 2-O-α-Glucosylglycerol (GG) is a natural heteroside synthesized by many cyanobacteria and a few heterotrophic bacteria under salt stress conditions. Bacteria produce GG in response to stimuli and ...2-O-α-Glucosylglycerol (GG) is a natural heteroside synthesized by many cyanobacteria and a few heterotrophic bacteria under salt stress conditions. Bacteria produce GG in response to stimuli and degrade it once the stimulus diminishes. Heterotrophic bacteria utilize GG phosphorylase (GGP), a member of the GH13_18 family, via a two-step process consisting of phosphorolysis and hydrolysis for GG catabolism. However, the precise mechanism by which GGP degrades GG remains elusive. We determined the 3D structure of a recently identified GGP (MsGGP) of the deep-sea bacterium Marinobacter salinexigens ZYF650, in complex with glucose and glycerol, α-d-glucose-1-phosphate (αGlc1-P), and orthophosphate (inorganic phosphate) at resolutions of 2.5, 2.7, and 2.7 Å, respectively. Notably, the first αGlc1-P complex structure in the GH13_18 family, the complex of MsGGP and αGlc1-P, validates that GGP catalyzes GG decomposition through consecutive phosphorolysis and hydrolysis. In addition, the structure reveals the mechanism of high stereoselectivity on αGlc1-P. Glu231 and Asp190 were identified as the catalytic residues. Interestingly, these structures closely resemble each other, indicating minimal conformational changes upon binding end-product glucose and glycerol, or the intermediate αGlc1-P. The structures also indicate that the substrates may follow a specific trajectory and a precise order toward the active center in close proximity and in a geometrically favorable orientation for catalysis in a double displacement mechanism. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_61086.map.gz emd_61086.map.gz | 59.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-61086-v30.xml emd-61086-v30.xml emd-61086.xml emd-61086.xml | 15.6 KB 15.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_61086.png emd_61086.png | 119 KB | ||
| Filedesc metadata |  emd-61086.cif.gz emd-61086.cif.gz | 5.6 KB | ||
| その他 |  emd_61086_half_map_1.map.gz emd_61086_half_map_1.map.gz emd_61086_half_map_2.map.gz emd_61086_half_map_2.map.gz | 59.3 MB 59.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-61086 http://ftp.pdbj.org/pub/emdb/structures/EMD-61086 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-61086 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-61086 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_61086_validation.pdf.gz emd_61086_validation.pdf.gz | 866.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_61086_full_validation.pdf.gz emd_61086_full_validation.pdf.gz | 866.1 KB | 表示 | |
| XML形式データ |  emd_61086_validation.xml.gz emd_61086_validation.xml.gz | 12.4 KB | 表示 | |
| CIF形式データ |  emd_61086_validation.cif.gz emd_61086_validation.cif.gz | 14.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-61086 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-61086 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-61086 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-61086 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_61086.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_61086.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.83 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_61086_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_61086_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex of human urea transport protein slc14A1 with urea
| 全体 | 名称: Complex of human urea transport protein slc14A1 with urea |
|---|---|
| 要素 |
|
-超分子 #1: Complex of human urea transport protein slc14A1 with urea
| 超分子 | 名称: Complex of human urea transport protein slc14A1 with urea タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Urea transporter 1
| 分子 | 名称: Urea transporter 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 42.566145 KDa |
| 組換発現 | 生物種:  Baculoviridae sp. (ウイルス) Baculoviridae sp. (ウイルス) |
| 配列 | 文字列: MEDSPTMVRV DSPTMVRGEN QVSPCQGRRC FPKALGYVTG DMKELANQLK DKPVVLQFID WILRGISQVV FVNNPVSGIL ILVGLLVQN PWWALTGWLG TVVSTLMALL LSQDRSLIAS GLYGYNATLV GVLMAVFSDK GDYFWWLLLP VCAMSMTCPI F SSALNSML ...文字列: MEDSPTMVRV DSPTMVRGEN QVSPCQGRRC FPKALGYVTG DMKELANQLK DKPVVLQFID WILRGISQVV FVNNPVSGIL ILVGLLVQN PWWALTGWLG TVVSTLMALL LSQDRSLIAS GLYGYNATLV GVLMAVFSDK GDYFWWLLLP VCAMSMTCPI F SSALNSML SKWDLPVFTL PFNMALSMYL SATGHYNPFF PAKLVIPITT APQISWSDLS ALELLKSIPV GVGQIYGCDN PW TGGIFLG AILLSSPLMC LHAAIGSLLG IAAGLSLSAP FEDIYFGLWG FNSSLACIAM GGMFMALTWQ THLLALGCAL FTA YLGVGM ANFMAEVGLP ACTWPFCLAT LLFLIMTTKN SNIYKMPLSK VTYPEENRIF YLQAKKRMVE SPL UniProtKB: Urea transporter 1 |
-分子 #2: UREA
| 分子 | 名称: UREA / タイプ: ligand / ID: 2 / コピー数: 15 / 式: URE |
|---|---|
| 分子量 | 理論値: 60.055 Da |
| Chemical component information | 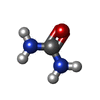 ChemComp-URE: |
-分子 #3: PALMITIC ACID
| 分子 | 名称: PALMITIC ACID / タイプ: ligand / ID: 3 / コピー数: 12 / 式: PLM |
|---|---|
| 分子量 | 理論値: 256.424 Da |
| Chemical component information |  ChemComp-PLM: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 糖包埋 | 材質: water |
| グリッド | モデル: Quantifoil R1.2/1.3 / 前処理 - タイプ: PLASMA CLEANING |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 80.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー








 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)




































