+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human myoferlin (1-1997) in complex with an MSP2N2 lipid nanodisc (15 mol% DOPS, 2 mol% PI(4,5)P2) | |||||||||
 マップデータ マップデータ | human myoferlin (1-1997) in complex with a lipid nanodisc (15 mol% DOPS, 2 mol% PIP2), consensus map (map M7) | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Ferlins / myoferlin / multi-C2 domains / lipid nanodisc / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of neurotransmitter secretion / plasma membrane repair / blood circulation / muscle contraction / phospholipid binding / caveola / centriolar satellite / synaptic vesicle membrane / nuclear envelope / cytoplasmic vesicle ...regulation of neurotransmitter secretion / plasma membrane repair / blood circulation / muscle contraction / phospholipid binding / caveola / centriolar satellite / synaptic vesicle membrane / nuclear envelope / cytoplasmic vesicle / nuclear membrane / cilium / ciliary basal body / intracellular membrane-bounded organelle / calcium ion binding / extracellular exosome / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.8 Å | |||||||||
 データ登録者 データ登録者 | Cretu C / Moser T | |||||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| |||||||||
 引用 引用 |  ジャーナル: EMBO J / 年: 2025 ジャーナル: EMBO J / 年: 2025タイトル: Structural insights into lipid membrane binding by human ferlins. 著者: Constantin Cretu / Aleksandar Chernev / Csaba Zoltán Kibédi Szabó / Vladimir Pena / Henning Urlaub / Tobias Moser / Julia Preobraschenski /   要旨: Ferlins are ancient membrane proteins with a unique architecture, and play central roles in crucial processes that involve Ca-dependent vesicle fusion. Despite their links to multiple human diseases ...Ferlins are ancient membrane proteins with a unique architecture, and play central roles in crucial processes that involve Ca-dependent vesicle fusion. Despite their links to multiple human diseases and numerous functional studies, a mechanistic understanding of how these multi-C domain-containing proteins interact with lipid membranes to promote membrane remodelling and fusion is currently lacking. Here we obtain near-complete cryo-electron microscopy structures of human myoferlin and dysferlin in their Ca- and lipid-bound states. We show that ferlins adopt compact, ring-like tertiary structures upon membrane binding. The top arch of the ferlin ring, composed of the CC-CD region, is rigid and exhibits only little variability across the observed functional states. In contrast, the N-terminal CB and the C-terminal CF-CG domains cycle between alternative conformations and, in response to Ca, close the ferlin ring, promoting tight interaction with the target membrane. Probing key domain interfaces validates the observed architecture, and informs a model of how ferlins engage lipid bilayers in a Ca-dependent manner. This work reveals the general principles of human ferlin structures and provides a framework for future analyses of ferlin-dependent cellular functions and disease mechanisms. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_53225.map.gz emd_53225.map.gz | 88.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-53225-v30.xml emd-53225-v30.xml emd-53225.xml emd-53225.xml | 25.4 KB 25.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_53225_fsc.xml emd_53225_fsc.xml | 11.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_53225.png emd_53225.png | 27.9 KB | ||
| マスクデータ |  emd_53225_msk_1.map emd_53225_msk_1.map | 178 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-53225.cif.gz emd-53225.cif.gz | 8.5 KB | ||
| その他 |  emd_53225_additional_1.map.gz emd_53225_additional_1.map.gz emd_53225_half_map_1.map.gz emd_53225_half_map_1.map.gz emd_53225_half_map_2.map.gz emd_53225_half_map_2.map.gz | 88.6 MB 165.4 MB 165.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-53225 http://ftp.pdbj.org/pub/emdb/structures/EMD-53225 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-53225 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-53225 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_53225_validation.pdf.gz emd_53225_validation.pdf.gz | 901.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_53225_full_validation.pdf.gz emd_53225_full_validation.pdf.gz | 900.9 KB | 表示 | |
| XML形式データ |  emd_53225_validation.xml.gz emd_53225_validation.xml.gz | 20.8 KB | 表示 | |
| CIF形式データ |  emd_53225_validation.cif.gz emd_53225_validation.cif.gz | 26.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-53225 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-53225 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-53225 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-53225 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_53225.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_53225.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | human myoferlin (1-1997) in complex with a lipid nanodisc (15 mol% DOPS, 2 mol% PIP2), consensus map (map M7) | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.72 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_53225_msk_1.map emd_53225_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: human myoferlin (1-1997) in complex with a lipid...
| ファイル | emd_53225_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | human myoferlin (1-1997) in complex with a lipid nanodisc (15 mol% DOPS, 2 mol% PIP2), overall map (map M8) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: human myoferlin (1-1997) in complex with a lipid...
| ファイル | emd_53225_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | human myoferlin (1-1997) in complex with a lipid nanodisc (15 mol% DOPS, 2 mol% PIP2), half map A (map M7) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: human myoferlin (1-1997) in complex with a lipid...
| ファイル | emd_53225_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | human myoferlin (1-1997) in complex with a lipid nanodisc (15 mol% DOPS, 2 mol% PIP2), half map B (map M7) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human myoferlin (1-1997) in complex with an MSP2N2 lipid nanodisc...
| 全体 | 名称: Human myoferlin (1-1997) in complex with an MSP2N2 lipid nanodisc (comprising 15 mol% DOPS and 2 mol% PI(4,5)P2) |
|---|---|
| 要素 |
|
-超分子 #1: Human myoferlin (1-1997) in complex with an MSP2N2 lipid nanodisc...
| 超分子 | 名称: Human myoferlin (1-1997) in complex with an MSP2N2 lipid nanodisc (comprising 15 mol% DOPS and 2 mol% PI(4,5)P2) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Myoferlin
| 分子 | 名称: Myoferlin / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 232.625953 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MASWSHPQFE KGGGSGGGSG GGSWSHPQFE KLEVLFQGPG SGDKDCEQSN AMLRVIVESA SNIPKTKFGK PDPIVSVIFK DEKKKTKKV DNELNPVWNE ILEFDLRGIP LDFSSSLGII VKDFETIGQN KLIGTATVAL KDLTGDQSRS LPYKLISLLN E RGQDTGAT ...文字列: MASWSHPQFE KGGGSGGGSG GGSWSHPQFE KLEVLFQGPG SGDKDCEQSN AMLRVIVESA SNIPKTKFGK PDPIVSVIFK DEKKKTKKV DNELNPVWNE ILEFDLRGIP LDFSSSLGII VKDFETIGQN KLIGTATVAL KDLTGDQSRS LPYKLISLLN E RGQDTGAT IDLVIGYDPP SAPHPNDLSG PSVPGMGGDG EEDEGDEDRL DNAVRGPGPK GPVGTVSEAQ LARRLTKVKN SR RMLSNKP QDFQIRVRVI EGRQLSGNNI RPVVKVHVCG QTHRTRIKRG NNPFFDELFF YNVNMTPSEL MDEIISIRVY NSH SLRADC LMGEFKIDVG FVYDEPGHAV MRKWLLLNDP EDTSSGSKGY MKVSMFVLGT GDEPPPERRD RDNDSDDVES NLLL PAGIA LRWVTFLLKI YRAEDIPQMD DAFSQTVKEI FGGNADKKNL VDPFVEVSFA GKKVCTNIIE KNANPEWNQV VNLQI KFPS VCEKIKLTIY DWDRLTKNDV VGTTYLHLSK IAASGGEVED FSSSGTGAAS YTVNTGETEV GFVPTFGPCY LNLYGS PRE YTGFPDPYDE LNTGKGEGVA YRGRILVELA TFLEKTPPDK KLEPISNDDL LVVEKYQRRR KYSLSAVFHS ATMLQDV GE AIQFEVSIGN YGNRFDTTCK PLASTTQYSR AVFDGNYYYY LPWAHTKPVV TLTSYWEDIS HRLDAVNTLL AMAERLQT N IEALKSGIQG KIPANQLAEL WLKLIDEVIE DTRYTLPLTE GKANVTVLDT QIRKLRSRSL SQIHEAAVRM RSEATDVKS TLAEIEDWLD KLMQLTEEPQ NSMPDIIIWM IRGEKRLAYA RIPAHQVLYS TSGENASGKY CGKTQTIFLK YPQEKNNGPK VPVELRVNI WLGLSAVEKK FNSFAEGTFT VFAEMYENQA LMFGKWGTSG LVGRHKFSDV TGKIKLKREF FLPPKGWEWE G EWIVDPER SLLTEADAGH TEFTDEVYQN ESRYPGGDWK PAEDTYTDAN GDKAASPSEL TCPPGWEWED DAWSYDINRA VD EKGWEYG ITIPPDHKPK SWVAAEKMYH THRRRRLVRK RKKDLTQTAS STARAMEELQ DQEGWEYASL IGWKFHWKQR SSD TFRRRR WRRKMAPSET HGAAAIFKLE GALGADTTED GDEKSLEKQK HSATTVFGAN TPIVSCNFDR VYIYHLRCYV YQAR NLLAL DKDSFSDPYA HICFLHRSKT TEIIHSTLNP TWDQTIIFDE VEIYGEPQTV LQNPPKVIME LFDNDQVGKD EFLGR SIFS PVVKLNSEMD ITPKLLWHPV MNGDKACGDV LVTAELILRG KDGSNLPILP PQRAPNLYMV PQGIRPVVQL TAIEIL AWG LRNMKNFQMA SITSPSLVVE CGGERVESVV IKNLKKTPNF PSSVLFMKVF LPKEELYMPP LVIKVIDHRQ FGRKPVV GQ CTIERLDRFR CDPYAGKEDI VPQLKASLLS APPCRDIVIE MEDTKPLLAS KLTEKEEEIV DWWSKFYASS GEHEKCGQ Y IQKGYSKLKI YNCELENVAE FEGLTDFSDT FKLYRGKSDE NEDPSVVGEF KGSFRIYPLP DDPSVPAPPR QFRELPDSV PQECTVRIYI VRGLELQPQD NNGLCDPYIK ITLGKKVIED RDHYIPNTLN PVFGRMYELS CYLPQEKDLK ISVYDYDTFT RDEKVGETI IDLENRFLSR FGSHCGIPEE YCVSGVNTWR DQLRPTQLLQ NVARFKGFPQ PILSEDGSRI RYGGRDYSLD E FEANKILH QHLGAPEERL ALHILRTQGL VPEHVETRTL HSTFQPNISQ GKLQMWVDVF PKSLGPPGPP FNITPRKAKK YY LRVIIWN TKDVILDEKS ITGEEMSDIY VKGWVPGNEE NKQKTDVHYR SLDGEGNFNW RFVFPFDYLP AEQLCIVAKK EHF WSIDQT EFRIPPRLII QIWDNDKFSL DDYLGFLELD LRHTIIPAKS PEKCRLDMIP DLKAMNPLKA KTASLFEQKS MKGW WPCYA EKDGARVMAG KVEMTLEILN EKEADERPAG KGRDEPNMNP KLD UniProtKB: Myoferlin |
-分子 #2: 1,2-DICAPROYL-SN-PHOSPHATIDYL-L-SERINE
| 分子 | 名称: 1,2-DICAPROYL-SN-PHOSPHATIDYL-L-SERINE / タイプ: ligand / ID: 2 / コピー数: 2 / 式: PSF |
|---|---|
| 分子量 | 理論値: 455.437 Da |
| Chemical component information | 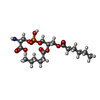 ChemComp-PSF: |
-分子 #3: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 3 / コピー数: 10 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.8 mg/mL | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||||||||||||
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: PLASMA CLEANING / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: AIR | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV 詳細: After the application of 3 uL sample (at A280~0.8), the grid was blotted for 7.5 s using a blot force 3.. | ||||||||||||||||||
| 詳細 | Prior to cryo-EM grid preparation, the sample was crosslinked with glutaraldehyde (0.05 % (v/v)) in batch, in the presence of 50 uM WJ460 (small-molecule inhibitor) and purified by size-exclusion chromatography on Superose 6 10/300. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: TFS Selectris / エネルギーフィルター - スリット幅: 10 eV |
| 詳細 | Objective aperture: 100 um |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 撮影したグリッド数: 1 / 実像数: 7305 / 平均露光時間: 3.46 sec. / 平均電子線量: 39.89 e/Å2 / 詳細: 7,014 movies were accepted after curation. |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.1 µm / 倍率(公称値): 165000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | Chain - Chain ID: D / Chain - Source name: AlphaFold / Chain - Initial model type: in silico model |
|---|---|
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL / 温度因子: 154.78 |
| 得られたモデル |  PDB-9qle: |
 ムービー
ムービー コントローラー
コントローラー

















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















































