+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of RyR1 in the primed state in the presence of pentoxifylline | |||||||||
 マップデータ マップデータ | Structure of human RyR1 in the primed state in the presence of pentoxifylline | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | calcium channel / TRANSPORT PROTEIN / sarcoplasmic reticulum | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cytoplasmic side of membrane / ATP-gated ion channel activity / ryanodine-sensitive calcium-release channel activity / terminal cisterna / ryanodine receptor complex / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / ossification involved in bone maturation / cellular response to caffeine / skin development / organelle membrane ...cytoplasmic side of membrane / ATP-gated ion channel activity / ryanodine-sensitive calcium-release channel activity / terminal cisterna / ryanodine receptor complex / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / ossification involved in bone maturation / cellular response to caffeine / skin development / organelle membrane / intracellularly gated calcium channel activity / smooth endoplasmic reticulum / outflow tract morphogenesis / regulation of ryanodine-sensitive calcium-release channel activity / toxic substance binding / striated muscle contraction / voltage-gated calcium channel activity / skeletal muscle fiber development / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / release of sequestered calcium ion into cytosol / sarcoplasmic reticulum membrane / muscle contraction / cellular response to calcium ion / sarcoplasmic reticulum / peptidylprolyl isomerase / peptidyl-prolyl cis-trans isomerase activity / sarcolemma / calcium ion transmembrane transport / calcium channel activity / Z disc / intracellular calcium ion homeostasis / disordered domain specific binding / protein homotetramerization / transmembrane transporter binding / calmodulin binding / intracellular membrane-bounded organelle / calcium ion binding / ATP binding / identical protein binding / membrane / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.68 Å | |||||||||
 データ登録者 データ登録者 | Miotto MC / Marks AR | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2025 ジャーナル: Proc Natl Acad Sci U S A / 年: 2025タイトル: Targeting ryanodine receptors with allopurinol and xanthine derivatives for the treatment of cardiac and musculoskeletal weakness disorders. 著者: Marco C Miotto / Estefania Luna-Figueroa / Carl Tchagou / Laith Bahlouli / Steven Reiken / Haikel Dridi / Yang Liu / Gunnar Weninger / Andrew R Marks /  要旨: Ryanodine receptors (RyRs) are intracellular Ca channels essential for muscle contraction. Caffeine, a xanthine derivative, has been known for decades to increase muscle contraction and enhance ...Ryanodine receptors (RyRs) are intracellular Ca channels essential for muscle contraction. Caffeine, a xanthine derivative, has been known for decades to increase muscle contraction and enhance activation of RyRs by increasing the sensitivity to Ca. We previously showed that xanthine, the only physiologically relevant xanthine derivative, also binds to and activates RyR2. Most xanthine derivatives and analogs are safe and widely prescribed, with the most popular being the xanthine oxidoreductase inhibitor allopurinol (~15M yearly prescriptions in USA). We propose that xanthine derivatives and analogs that enhance RyRs activity could be used for lead optimization and eventually for the treatment of the diseases that exhibit decreased muscle contraction and reduced RyRs activity, such as RyR1-related diseases, sarcopenia, and heart failure. Here, we show by cryo-EM that xanthine derivatives, analogs, and other related compounds bind to the xanthine/caffeine binding site and activate RyR1, and identify 4-oxopyrimidine as the minimal motif necessary for such interaction. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_47385.map.gz emd_47385.map.gz | 255.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-47385-v30.xml emd-47385-v30.xml emd-47385.xml emd-47385.xml | 31.2 KB 31.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_47385.png emd_47385.png | 136.2 KB | ||
| Filedesc metadata |  emd-47385.cif.gz emd-47385.cif.gz | 10.2 KB | ||
| その他 |  emd_47385_additional_1.map.gz emd_47385_additional_1.map.gz emd_47385_half_map_1.map.gz emd_47385_half_map_1.map.gz emd_47385_half_map_2.map.gz emd_47385_half_map_2.map.gz | 257.7 MB 474 MB 474 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-47385 http://ftp.pdbj.org/pub/emdb/structures/EMD-47385 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-47385 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-47385 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_47385_validation.pdf.gz emd_47385_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_47385_full_validation.pdf.gz emd_47385_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_47385_validation.xml.gz emd_47385_validation.xml.gz | 18.7 KB | 表示 | |
| CIF形式データ |  emd_47385_validation.cif.gz emd_47385_validation.cif.gz | 22.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47385 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47385 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47385 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-47385 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9e18MC  9e17C  9e19C  9e1aC  9e1bC  9e1cC  9e1dC  9e1eC  9e1fC  9e1gC  9e1hC  9e1iC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_47385.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_47385.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Structure of human RyR1 in the primed state in the presence of pentoxifylline | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.837 Å | ||||||||||||||||||||||||||||||||||||
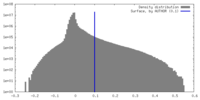
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Structure of human RyR1 in the primed state...
| ファイル | emd_47385_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Structure of human RyR1 in the primed state in the presence of pentoxifylline - focused map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
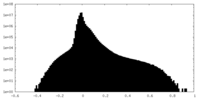
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_47385_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_47385_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : Complex of RyR1 and Calstabin-1
+超分子 #1: Complex of RyR1 and Calstabin-1
+超分子 #2: Ryanodine Receptor 1
+超分子 #3: Calstabin-1
+分子 #1: Ryanodine receptor 1
+分子 #2: Peptidyl-prolyl cis-trans isomerase FKBP1A
+分子 #3: ADENOSINE-5'-TRIPHOSPHATE
+分子 #4: CALCIUM ION
+分子 #5: ZINC ION
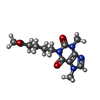
+分子 #6: 3,7-DIMETHYL-1-(5-OXOHEXYL)-3,7-DIHYDRO-1H-PURINE-2,6-DIONE
+分子 #7: water
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 10 mg/mL | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
詳細: 2 mM pentoxifylline was added to the final sample from a 20 mM stock solution in buffer. | |||||||||||||||||||||||||||
| グリッド | モデル: UltrAuFoil R0./1 / 材質: GOLD / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE | |||||||||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 温度 | 最低: 80.0 K / 最高: 100.0 K |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / 平均電子線量: 58.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)