+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4619 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of dimeric quinol dependent nitric oxide reductase (qNOR) Val495Ala mutant from Alcaligenes xylosoxidans | |||||||||||||||
 マップデータ マップデータ | ||||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | Proton Transfer / Membrane Protein / Homodimer / OXIDOREDUCTASE | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報nitric oxide reductase (cytochrome c) / nitric oxide reductase activity / cytochrome-c oxidase activity / aerobic respiration / heme binding / membrane 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Achromobacter xylosoxidans (バクテリア) / Achromobacter xylosoxidans (バクテリア) /  Alcaligenes xylosoxydans xylosoxydans (バクテリア) Alcaligenes xylosoxydans xylosoxydans (バクテリア) | |||||||||||||||
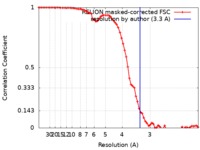
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.3 Å | |||||||||||||||
 データ登録者 データ登録者 | Gopalasingam CC / Johnson RM / Chiduza GN | |||||||||||||||
| 資金援助 |  英国, 4件 英国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2019 ジャーナル: Sci Adv / 年: 2019タイトル: Dimeric structures of quinol-dependent nitric oxide reductases (qNORs) revealed by cryo-electron microscopy. 著者: Chai C Gopalasingam / Rachel M Johnson / George N Chiduza / Takehiko Tosha / Masaki Yamamoto / Yoshitsugu Shiro / Svetlana V Antonyuk / Stephen P Muench / S Samar Hasnain /   要旨: Quinol-dependent nitric oxide reductases (qNORs) are membrane-integrated, iron-containing enzymes of the denitrification pathway, which catalyze the reduction of nitric oxide (NO) to the major ozone ...Quinol-dependent nitric oxide reductases (qNORs) are membrane-integrated, iron-containing enzymes of the denitrification pathway, which catalyze the reduction of nitric oxide (NO) to the major ozone destroying gas nitrous oxide (NO). Cryo-electron microscopy structures of active qNOR from and an activity-enhancing mutant have been determined to be at local resolutions of 3.7 and 3.2 Å, respectively. They unexpectedly reveal a dimeric conformation (also confirmed for qNOR from ) and define the active-site configuration, with a clear water channel from the cytoplasm. Structure-based mutagenesis has identified key residues involved in proton transport and substrate delivery to the active site of qNORs. The proton supply direction differs from cytochrome c-dependent NOR (cNOR), where water molecules from the cytoplasm serve as a proton source similar to those from cytochrome c oxidase. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4619.map.gz emd_4619.map.gz | 20.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4619-v30.xml emd-4619-v30.xml emd-4619.xml emd-4619.xml | 15.1 KB 15.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_4619_fsc.xml emd_4619_fsc.xml | 7.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_4619.png emd_4619.png | 65.6 KB | ||
| Filedesc metadata |  emd-4619.cif.gz emd-4619.cif.gz | 6.9 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4619 http://ftp.pdbj.org/pub/emdb/structures/EMD-4619 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4619 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4619 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_4619_validation.pdf.gz emd_4619_validation.pdf.gz | 269.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_4619_full_validation.pdf.gz emd_4619_full_validation.pdf.gz | 269 KB | 表示 | |
| XML形式データ |  emd_4619_validation.xml.gz emd_4619_validation.xml.gz | 9.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4619 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4619 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4619 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4619 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4619.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4619.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.05 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Quinol Dependent Nitric Oxide Reductase
| 全体 | 名称: Quinol Dependent Nitric Oxide Reductase |
|---|---|
| 要素 |
|
-超分子 #1: Quinol Dependent Nitric Oxide Reductase
| 超分子 | 名称: Quinol Dependent Nitric Oxide Reductase / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Achromobacter xylosoxidans (バクテリア) Achromobacter xylosoxidans (バクテリア) |
| 分子量 | 理論値: 170 KDa |
-分子 #1: Nitric oxide reductase subunit B
| 分子 | 名称: Nitric oxide reductase subunit B / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO / EC番号: nitric oxide reductase (cytochrome c) |
|---|---|
| 由来(天然) | 生物種:  Alcaligenes xylosoxydans xylosoxydans (バクテリア) Alcaligenes xylosoxydans xylosoxydans (バクテリア) |
| 分子量 | 理論値: 83.093938 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MGPYRRLWFT LIAVLAVTFA LLGFYGGEVY RQAPPIPEEV ASADGTRLFG RDDILDGQTA WQSIGGMQLG SIWGHGAYQA PDWTADWLH RELMAWLDLA ARDAHGRDYG QLDAPAQAAL REQLKAEYRA NRADAAGGKL TLSPRRAQAV AQTEAYYDQL F SDAPALHR ...文字列: MGPYRRLWFT LIAVLAVTFA LLGFYGGEVY RQAPPIPEEV ASADGTRLFG RDDILDGQTA WQSIGGMQLG SIWGHGAYQA PDWTADWLH RELMAWLDLA ARDAHGRDYG QLDAPAQAAL REQLKAEYRA NRADAAGGKL TLSPRRAQAV AQTEAYYDQL F SDAPALHR SRENYAMKEN TLPDANRRRQ MTHFFFWTAW AAGTEREGTS VTYTNNWPHE PLIGNHPSSE NVMWSIISVV VL LAGIGLL IWAWAFLRGK EEDEPPAPAR DPLTTFALTP SQRALGKYLF LVVALFGFQV LLGGFTAHYT VEGQKFYGID LSQ WFPYSL VRTWHIQSAL FWIATGFLAA GLFLAPLING GRDPKYQKAG VDILFWALVL VVVGSFAGNY LAIAQIMPPD LNFW LGHQG YEYVDLGRLW QIGKFAGICF WLVLMLRGIV PALRTPGGDK NLLALLTASV GAIGLFYGAG FFYGERTHLT VMEYW RWWI VHLWVEGFFE AFATTALAFI FSTLGLVSRR MATTASLASA SLFMLGGIPG TFHHLYFAGT TTPVMAVGAS FSALEV VPL IVLGHEAWEN WRLKTRAPWM ENLKWPLMCF VAVAFWNMLG AGVFGFMINP PVSLYYIQGL NTTPVHAHAA LFGVYGF LA LGFTLLVLRY IRPQYALSPG LMKLAFWGLN LGLALMIFTS LLPIGLIQFH ASVSEGMWYA RSEAFMQQDI LKTLRWGR T FGDVVFLLGA LAMVVQVILG LLSGK UniProtKB: Nitric oxide reductase subunit B |
-分子 #2: PROTOPORPHYRIN IX CONTAINING FE
| 分子 | 名称: PROTOPORPHYRIN IX CONTAINING FE / タイプ: ligand / ID: 2 / コピー数: 4 / 式: HEM |
|---|---|
| 分子量 | 理論値: 616.487 Da |
| Chemical component information |  ChemComp-HEM: |
-分子 #3: FE (III) ION
| 分子 | 名称: FE (III) ION / タイプ: ligand / ID: 3 / コピー数: 2 / 式: FE |
|---|---|
| 分子量 | 理論値: 55.845 Da |
-分子 #4: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 4 / コピー数: 2 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-分子 #5: (1R)-2-{[(R)-(2-AMINOETHOXY)(HYDROXY)PHOSPHORYL]OXY}-1-[(DODECANO...
| 分子 | 名称: (1R)-2-{[(R)-(2-AMINOETHOXY)(HYDROXY)PHOSPHORYL]OXY}-1-[(DODECANOYLOXY)METHYL]ETHYL (9Z)-OCTADEC-9-ENOATE タイプ: ligand / ID: 5 / コピー数: 3 / 式: LOP |
|---|---|
| 分子量 | 理論値: 661.89 Da |
| Chemical component information |  ChemComp-LOP: |
-分子 #6: DODECYL-BETA-D-MALTOSIDE
| 分子 | 名称: DODECYL-BETA-D-MALTOSIDE / タイプ: ligand / ID: 6 / コピー数: 2 / 式: LMT |
|---|---|
| 分子量 | 理論値: 510.615 Da |
| Chemical component information |  ChemComp-LMT: |
-分子 #7: water
| 分子 | 名称: water / タイプ: ligand / ID: 7 / コピー数: 18 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: Blot for 6 seconds with blot force of 6 prior to plunge freezing. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 実像数: 1803 / 平均電子線量: 49.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): -3.0 µm / 最小 デフォーカス(公称値): -1.2 µm / 倍率(公称値): 47710 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)