[English] 日本語
 Yorodumi
Yorodumi- EMDB-45760: HIV-2 CA hexamer bound with Nup153 peptide; assembled with liposo... -
+ Open data
Open data
- Basic information
Basic information
| Entry |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Title | HIV-2 CA hexamer bound with Nup153 peptide; assembled with liposome templating | ||||||||||||
 Map data Map data | EM map of HIV-2 CA hexamers assembled via liposome templating with Nup153 peptide allowed to bind. | ||||||||||||
 Sample Sample |
| ||||||||||||
 Keywords Keywords | HIV-2 / Capsid / IP6 / Nup153 / VIRAL PROTEIN | ||||||||||||
| Function / homology |  Function and homology information Function and homology informationHIV-2 retropepsin / negative regulation of RNA export from nucleus / nuclear pore complex assembly / Nuclear Pore Complex (NPC) Disassembly / nuclear inclusion body / Regulation of Glucokinase by Glucokinase Regulatory Protein / Defective TPR may confer susceptibility towards thyroid papillary carcinoma (TPC) / nuclear pore nuclear basket / Transport of Ribonucleoproteins into the Host Nucleus / Transport of the SLBP independent Mature mRNA ...HIV-2 retropepsin / negative regulation of RNA export from nucleus / nuclear pore complex assembly / Nuclear Pore Complex (NPC) Disassembly / nuclear inclusion body / Regulation of Glucokinase by Glucokinase Regulatory Protein / Defective TPR may confer susceptibility towards thyroid papillary carcinoma (TPC) / nuclear pore nuclear basket / Transport of Ribonucleoproteins into the Host Nucleus / Transport of the SLBP independent Mature mRNA / Transport of the SLBP Dependant Mature mRNA / NS1 Mediated Effects on Host Pathways / SUMOylation of SUMOylation proteins / structural constituent of nuclear pore / Transport of Mature mRNA Derived from an Intronless Transcript / Rev-mediated nuclear export of HIV RNA / SUMOylation of RNA binding proteins / Nuclear import of Rev protein / NEP/NS2 Interacts with the Cellular Export Machinery / Transport of Mature mRNA derived from an Intron-Containing Transcript / RNA export from nucleus / tRNA processing in the nucleus / nucleocytoplasmic transport / nuclear localization sequence binding / Viral Messenger RNA Synthesis / SUMOylation of ubiquitinylation proteins / Vpr-mediated nuclear import of PICs / SUMOylation of DNA replication proteins / Regulation of HSF1-mediated heat shock response / mRNA transport / nuclear pore / SUMOylation of DNA damage response and repair proteins / protein-membrane adaptor activity / nuclear periphery / SUMOylation of chromatin organization proteins / HCMV Late Events / retroviral ribonuclease H / exoribonuclease H / molecular condensate scaffold activity / exoribonuclease H activity / Transcriptional regulation by small RNAs / DNA integration / viral genome integration into host DNA / establishment of integrated proviral latency / RNA-directed DNA polymerase / RNA stem-loop binding / ISG15 antiviral mechanism / viral penetration into host nucleus / host multivesicular body / RNA-directed DNA polymerase activity / RNA-DNA hybrid ribonuclease activity / protein import into nucleus / HCMV Early Events / Transferases; Transferring phosphorus-containing groups; Nucleotidyltransferases / nuclear envelope / host cell / viral nucleocapsid / snRNP Assembly / DNA recombination / nuclear membrane / amyloid fibril formation / DNA-directed DNA polymerase / aspartic-type endopeptidase activity / Hydrolases; Acting on ester bonds / DNA-directed DNA polymerase activity / symbiont-mediated suppression of host gene expression / viral translational frameshifting / symbiont entry into host cell / lipid binding / nucleolus / host cell nucleus / host cell plasma membrane / SARS-CoV-2 activates/modulates innate and adaptive immune responses / virion membrane / structural molecule activity / proteolysis / DNA binding / zinc ion binding / nucleoplasm / identical protein binding / membrane / cytosol Similarity search - Function | ||||||||||||
| Biological species |  Human immunodeficiency virus 2 / Human immunodeficiency virus 2 /  Homo sapiens (human) Homo sapiens (human) | ||||||||||||
| Method | single particle reconstruction / cryo EM / Resolution: 2.99 Å | ||||||||||||
 Authors Authors | Freniere C / Cook M / Xiong Y | ||||||||||||
| Funding support |  United States, 3 items United States, 3 items
| ||||||||||||
 Citation Citation |  Journal: Cell Rep / Year: 2025 Journal: Cell Rep / Year: 2025Title: Structural insights into HIV-2 CA lattice formation and FG-pocket binding revealed by single-particle cryo-EM. Authors: Matthew Cook / Christian Freniere / Chunxiang Wu / Faith Lozano / Yong Xiong /  Abstract: One of the striking features of human immunodeficiency virus (HIV) is the capsid, a fullerene cone comprised of pleomorphic capsid protein (CA) that shields the viral genome and recruits cofactors. ...One of the striking features of human immunodeficiency virus (HIV) is the capsid, a fullerene cone comprised of pleomorphic capsid protein (CA) that shields the viral genome and recruits cofactors. Despite significant advances in understanding the mechanisms of HIV-1 CA assembly and host factor interactions, HIV-2 CA assembly remains poorly understood. By templating the assembly of HIV-2 CA on functionalized liposomes, we report high-resolution structures of the HIV-2 CA lattice, including both CA hexamers and pentamers, alone and with peptides of host phenylalanine-glycine (FG)-motif proteins Nup153 and CPSF6. While the overall fold and mode of FG-peptide binding is conserved with HIV-1, this study reveals distinctive features of the HIV-2 CA lattice, including differing structural character at regions of host factor interactions and divergence in the mechanism of formation of CA hexamers and pentamers. This study extends our understanding of HIV capsids and highlights an approach facilitating the study of lentiviral capsid biology. | ||||||||||||
| History |
|
- Structure visualization
Structure visualization
| Supplemental images |
|---|
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_45760.map.gz emd_45760.map.gz | 10.2 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-45760-v30.xml emd-45760-v30.xml emd-45760.xml emd-45760.xml | 24.3 KB 24.3 KB | Display Display |  EMDB header EMDB header |
| FSC (resolution estimation) |  emd_45760_fsc.xml emd_45760_fsc.xml | 5.9 KB | Display |  FSC data file FSC data file |
| Images |  emd_45760.png emd_45760.png | 173.3 KB | ||
| Filedesc metadata |  emd-45760.cif.gz emd-45760.cif.gz | 7.5 KB | ||
| Others |  emd_45760_half_map_1.map.gz emd_45760_half_map_1.map.gz emd_45760_half_map_2.map.gz emd_45760_half_map_2.map.gz | 19.6 MB 19.6 MB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-45760 http://ftp.pdbj.org/pub/emdb/structures/EMD-45760 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45760 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45760 | HTTPS FTP |
-Related structure data
| Related structure data |  9cnuMC  9cljC  9cnsC  9cntC  9cnvC M: atomic model generated by this map C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| Related items in Molecule of the Month |
- Map
Map
| File |  Download / File: emd_45760.map.gz / Format: CCP4 / Size: 22.2 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_45760.map.gz / Format: CCP4 / Size: 22.2 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | EM map of HIV-2 CA hexamers assembled via liposome templating with Nup153 peptide allowed to bind. | ||||||||||||||||||||||||||||||||||||
| Projections & slices | Image control
Images are generated by Spider. | ||||||||||||||||||||||||||||||||||||
| Voxel size | X=Y=Z: 1.068 Å | ||||||||||||||||||||||||||||||||||||
| Density |
| ||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
|
-Supplemental data
-Half map: EM half map A of HIV-2 CA hexamer bound with Nup153 peptide.
| File | emd_45760_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | EM half map A of HIV-2 CA hexamer bound with Nup153 peptide. | ||||||||||||
| Projections & Slices |
| ||||||||||||
| Density Histograms |
-Half map: EM half map B of HIV-2 CA hexamer bound with Nup153 peptide.
| File | emd_45760_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | EM half map B of HIV-2 CA hexamer bound with Nup153 peptide. | ||||||||||||
| Projections & Slices |
| ||||||||||||
| Density Histograms |
- Sample components
Sample components
-Entire : HIV-2 capsid protein assembled into a lattice via liposome templa...
| Entire | Name: HIV-2 capsid protein assembled into a lattice via liposome templating and then bound with Nup153 peptide. |
|---|---|
| Components |
|
-Supramolecule #1: HIV-2 capsid protein assembled into a lattice via liposome templa...
| Supramolecule | Name: HIV-2 capsid protein assembled into a lattice via liposome templating and then bound with Nup153 peptide. type: complex / ID: 1 / Parent: 0 / Macromolecule list: #1-#2 Details: C-terminally hexahistidine tagged HIV-2 CA associated with a liposome decorated with NiNTA headgroups which results in the assembly of a lattice of CA. Nup153 peptide is subsequently ...Details: C-terminally hexahistidine tagged HIV-2 CA associated with a liposome decorated with NiNTA headgroups which results in the assembly of a lattice of CA. Nup153 peptide is subsequently introduced and binding is allowed to equilibrate. |
|---|---|
| Molecular weight | Theoretical: 26.9 KDa |
-Supramolecule #2: HIV-2 capsid protein
| Supramolecule | Name: HIV-2 capsid protein / type: complex / ID: 2 / Parent: 1 / Macromolecule list: #1 |
|---|---|
| Source (natural) | Organism:  Human immunodeficiency virus 2 / Strain: GL-AN Human immunodeficiency virus 2 / Strain: GL-AN |
-Supramolecule #3: Nup153 peptide
| Supramolecule | Name: Nup153 peptide / type: complex / ID: 3 / Parent: 1 / Macromolecule list: #2 |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) / Synthetically produced: Yes Homo sapiens (human) / Synthetically produced: Yes |
-Macromolecule #1: Capsid protein p24
| Macromolecule | Name: Capsid protein p24 / type: protein_or_peptide / ID: 1 Details: HIV-2 GL-AN capsid protein with C-terminal Gly-Ser-Ser linker followed by a hexahistidine tag after proteolytic processing of the N-terminal Met. Number of copies: 1 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  Human immunodeficiency virus 2 / Strain: GL-AN Human immunodeficiency virus 2 / Strain: GL-AN |
| Molecular weight | Theoretical: 26.80949 KDa |
| Recombinant expression | Organism:  |
| Sequence | String: PVQQTGGGNY IHVPLSPRTL NAWVKLVEDK KFGAEVVPGF QALSEGCTPY DINQMLNCVG DHQAAMQIIR EIINDEAADW DAQHPIPGP LPAGQLRDPR GSDIAGTTST VEEQIQWMYR PQNPVPVGNI YRRWIQIGLQ KCVRMYNPTN ILDVKQGPKE P FQSYVDRF ...String: PVQQTGGGNY IHVPLSPRTL NAWVKLVEDK KFGAEVVPGF QALSEGCTPY DINQMLNCVG DHQAAMQIIR EIINDEAADW DAQHPIPGP LPAGQLRDPR GSDIAGTTST VEEQIQWMYR PQNPVPVGNI YRRWIQIGLQ KCVRMYNPTN ILDVKQGPKE P FQSYVDRF YKSLRAEQTD PAVKNWMTQT LLIQNANPDC KLVLKGLGMN PTLEEMLTAC QGVGGPGQKA RLMGSSHHHH HH UniProtKB: Gag-Pol polyprotein |
-Macromolecule #2: Nuclear pore complex protein Nup153
| Macromolecule | Name: Nuclear pore complex protein Nup153 / type: protein_or_peptide / ID: 2 Details: Peptide of Nup153, residues 1411-1425 and 1464-1475 Number of copies: 1 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Molecular weight | Theoretical: 2.897363 KDa |
| Sequence | String: PSGVFTFGAN SSTPAGRKIK TAVRRRK UniProtKB: Nuclear pore complex protein Nup153, Nuclear pore complex protein Nup153 |
-Macromolecule #3: INOSITOL HEXAKISPHOSPHATE
| Macromolecule | Name: INOSITOL HEXAKISPHOSPHATE / type: ligand / ID: 3 / Number of copies: 2 / Formula: IHP |
|---|---|
| Molecular weight | Theoretical: 660.035 Da |
| Chemical component information | 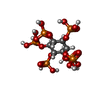 ChemComp-IHP: |
-Experimental details
-Structure determination
| Method | cryo EM |
|---|---|
 Processing Processing | single particle reconstruction |
| Aggregation state | particle |
- Sample preparation
Sample preparation
| Concentration | 10.7 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Buffer | pH: 7 Component:
Details: The mixed buffer of storage buffer for the protein and lipid components with IP6 supplemented. | |||||||||||||||
| Grid | Model: Quantifoil R2/1 / Material: COPPER / Mesh: 200 / Support film - Material: CARBON / Support film - topology: HOLEY ARRAY / Support film - Film thickness: 12 / Pretreatment - Type: GLOW DISCHARGE / Pretreatment - Time: 45 sec. / Pretreatment - Atmosphere: AIR / Pretreatment - Pressure: 0.015 kPa / Details: 15 mA discharge current. | |||||||||||||||
| Vitrification | Cryogen name: ETHANE / Chamber humidity: 100 % / Chamber temperature: 298 K / Instrument: FEI VITROBOT MARK IV Details: Grids were dual-side blotted with blot force 0 for 5.5 sec before plunge freezing in liquid ethane.. | |||||||||||||||
| Details | Sample was prepared with 400 uM HIV-2 CA-6xHis protein, 5.9 mM lipid mix (described in publication), and 4 mM IP6 final concentrations after subsequent addition. Nup153 peptide was then introduced to 400 uM final concentration. Sample was well-distributed on the grid, mostly monodisperse. Perhaps slightly more particles on carbon versus in the hole. |
- Electron microscopy
Electron microscopy
| Microscope | FEI TITAN KRIOS |
|---|---|
| Specialist optics | Energy filter - Name: GIF Quantum LS / Energy filter - Slit width: 20 eV |
| Image recording | Film or detector model: GATAN K3 (6k x 4k) / Average electron dose: 50.0 e/Å2 |
| Electron beam | Acceleration voltage: 300 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | C2 aperture diameter: 30.0 µm / Illumination mode: FLOOD BEAM / Imaging mode: BRIGHT FIELD / Cs: 2.7 mm / Nominal defocus max: 2.0 µm / Nominal defocus min: 0.8 µm / Nominal magnification: 81000 |
| Sample stage | Specimen holder model: FEI TITAN KRIOS AUTOGRID HOLDER / Cooling holder cryogen: NITROGEN |
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
+ Image processing
Image processing
-Atomic model buiding 1
| Initial model | PDB ID: Chain - Chain ID: A / Chain - Residue range: 1-223 / Chain - Source name: Other / Chain - Initial model type: experimental model Details: NTDs matched well, but the CTD had to be realigned. |
|---|---|
| Details | The HIV-2 CA pentamer chain derived from micelle-templated icosahedra described in this publication was used as an initial model for fitting. Flexible fitting was used to move the CTD into its proper location. The peptide was modeled by backbone tracing. |
| Refinement | Space: REAL / Protocol: OTHER / Target criteria: Cross-correlation coefficient |
| Output model |  PDB-9cnu: |
 Movie
Movie Controller
Controller





























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






































