+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-3336 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo electron microscopy of a complex of Tor-1175RFP and Lst8 | |||||||||
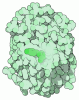
 マップデータ マップデータ | Reconstruction of a complex of variant Tor-1175RFP and Lst8. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | cryo-EM / Tor / Lst8 / mTOR / kinase / PIKK / S/T protein kinase / TORC1 / mTORC1 / RFP | |||||||||
| 機能・相同性 | TORC1 complex / Green fluorescent protein, GFP / Green fluorescent protein-related / Green fluorescent protein / Green fluorescent protein / bioluminescence / generation of precursor metabolites and energy / Red fluorescent protein drFP583 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Kluyveromyces marxianus (酵母) / Kluyveromyces marxianus (酵母) /  Discosoma sp. (イソギンチャク) Discosoma sp. (イソギンチャク) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 10.3 Å | |||||||||
 データ登録者 データ登録者 | Baretic D / Berndt A / Ohashi Y / Johnson CM / Williams RL | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2016 ジャーナル: Nat Commun / 年: 2016タイトル: Tor forms a dimer through an N-terminal helical solenoid with a complex topology. 著者: Domagoj Baretić / Alex Berndt / Yohei Ohashi / Christopher M Johnson / Roger L Williams /  要旨: The target of rapamycin (Tor) is a Ser/Thr protein kinase that regulates a range of anabolic and catabolic processes. Tor is present in two complexes, TORC1 and TORC2, in which the Tor-Lst8 ...The target of rapamycin (Tor) is a Ser/Thr protein kinase that regulates a range of anabolic and catabolic processes. Tor is present in two complexes, TORC1 and TORC2, in which the Tor-Lst8 heterodimer forms a common sub-complex. We have determined the cryo-electron microscopy (EM) structure of Tor bound to Lst8. Two Tor-Lst8 heterodimers assemble further into a dyad-symmetry dimer mediated by Tor-Tor interactions. The first 1,300 residues of Tor form a HEAT repeat-containing α-solenoid with four distinct segments: a highly curved 800-residue N-terminal 'spiral', followed by a 400-residue low-curvature 'bridge' and an extended 'railing' running along the bridge leading to the 'cap' that links to FAT region. This complex topology was verified by domain insertions and offers a new interpretation of the mTORC1 structure. The spiral of one TOR interacts with the bridge of another, which together form a joint platform for the Regulatory Associated Protein of TOR (RAPTOR) regulatory subunit. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_3336.map.gz emd_3336.map.gz | 96.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-3336-v30.xml emd-3336-v30.xml emd-3336.xml emd-3336.xml | 10.3 KB 10.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_3336_fsc.xml emd_3336_fsc.xml | 10 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_3336.png emd_3336.png | 29.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-3336 http://ftp.pdbj.org/pub/emdb/structures/EMD-3336 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3336 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3336 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_3336_validation.pdf.gz emd_3336_validation.pdf.gz | 286.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_3336_full_validation.pdf.gz emd_3336_full_validation.pdf.gz | 285.9 KB | 表示 | |
| XML形式データ |  emd_3336_validation.xml.gz emd_3336_validation.xml.gz | 11.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3336 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3336 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3336 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3336 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_3336.map.gz / 形式: CCP4 / 大きさ: 100.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_3336.map.gz / 形式: CCP4 / 大きさ: 100.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Reconstruction of a complex of variant Tor-1175RFP and Lst8. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.34 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Complex of Tor-1175RFP with Lst8
| 全体 | 名称: Complex of Tor-1175RFP with Lst8 |
|---|---|
| 要素 |
|
-超分子 #1000: Complex of Tor-1175RFP with Lst8
| 超分子 | 名称: Complex of Tor-1175RFP with Lst8 / タイプ: sample / ID: 1000 / 集合状態: Dimer of Tor-1175RFP/Lst8 heterodimers / Number unique components: 3 |
|---|---|
| 分子量 | 理論値: 738 KDa |
-分子 #1: Target of rapamycin (Tor)
| 分子 | 名称: Target of rapamycin (Tor) / タイプ: protein_or_peptide / ID: 1 / Name.synonym: Tor / コピー数: 2 / 集合状態: dimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Kluyveromyces marxianus (酵母) Kluyveromyces marxianus (酵母) |
| 分子量 | 理論値: 277 KDa |
| 組換発現 | 生物種:  Kluyveromyces marxianus (酵母) Kluyveromyces marxianus (酵母) |
| 配列 | GO: TORC1 complex |
-分子 #2: Lst8
| 分子 | 名称: Lst8 / タイプ: protein_or_peptide / ID: 2 / Name.synonym: Lethal with SEC13 protein 8 / コピー数: 2 / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Kluyveromyces marxianus (酵母) Kluyveromyces marxianus (酵母) |
| 分子量 | 理論値: 34 KDa |
| 組換発現 | 生物種:  Kluyveromyces marxianus (酵母) Kluyveromyces marxianus (酵母) |
-分子 #3: Red fluorescent protein (RFP)
| 分子 | 名称: Red fluorescent protein (RFP) / タイプ: protein_or_peptide / ID: 3 / Name.synonym: RFP, dsRed, FP583 詳細: The tandem RFP was inserted between residues T1175 and K1176 of K. marxianus Target of rapamycin (Tor) polypeptide chain. コピー数: 4 / 集合状態: Dimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Discosoma sp. (イソギンチャク) / 別称: Coral anemones Discosoma sp. (イソギンチャク) / 別称: Coral anemones |
| 分子量 | 理論値: 54 KDa |
| 組換発現 | 生物種:  Kluyveromyces marxianus (酵母) Kluyveromyces marxianus (酵母) |
| 配列 | UniProtKB: Red fluorescent protein drFP583 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 詳細: 50 mM Hepes pH 7.4 (23 deg C), 75 mM KCl, 250 mM NaCl, 0.3 % (v/v) CHAPS, 1 mM TCEP |
| グリッド | 詳細: Quantifoil Au R 1.2/1.3, 300 mesh grids, blotted for 11-13 s at 4 deg C |
| 凍結 | 凍結剤: ETHANE / 装置: OTHER / 手法: 11-13 s at 4 deg C |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 日付 | 2016年1月14日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 実像数: 465 / 平均電子線量: 40 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 105263 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 3.0 µm / 倍率(公称値): 78000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






















