+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-32005 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Focused refinement of asymmetric unit of bacteriophage lambda procapsid at 3.88 Angstrom | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | bacteriophage lambda / capsid / procapsid / capsid maturation / virus structure / cryo-EM / auxiliary protein / conformational expansion / cementing protein / DNA packaging / VIRUS | |||||||||
| 機能・相同性 | Major capsid protein GpE / Phage major capsid protein E / T=7 icosahedral viral capsid / viral capsid / host cell cytoplasm / Major capsid protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Escherichia phage lambda (λファージ) / Escherichia phage lambda (λファージ) /  Escherichia virus Lambda (ウイルス) Escherichia virus Lambda (ウイルス) | |||||||||
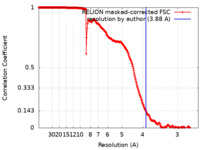
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.88 Å | |||||||||
 データ登録者 データ登録者 | Wang JW | |||||||||
| 資金援助 |  中国, 2件 中国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2022 ジャーナル: Structure / 年: 2022タイトル: Structural basis of bacteriophage lambda capsid maturation. 著者: Chang Wang / Jianwei Zeng / Jiawei Wang /  要旨: Bacteriophage lambda is an excellent model system for studying capsid assembly of double-stranded DNA (dsDNA) bacteriophages, some dsDNA archaeal viruses, and herpesviruses. HK97 fold coat proteins ...Bacteriophage lambda is an excellent model system for studying capsid assembly of double-stranded DNA (dsDNA) bacteriophages, some dsDNA archaeal viruses, and herpesviruses. HK97 fold coat proteins initially assemble into a precursor capsid (procapsid) and subsequent genome packaging triggers morphological expansion of the shell. An auxiliary protein is required to stabilize the expanded capsid structure. To investigate the capsid maturation mechanism, we determined the cryo-electron microscopy structures of the bacteriophage lambda procapsid and mature capsid at 3.88 Å and 3.76 Å resolution, respectively. Besides primarily rigid body movements of common features of the major capsid protein gpE, large-scale structural rearrangements of other domains occur simultaneously. Assembly of intercapsomers within the procapsid is facilitated by layer-stacking effects at 3-fold vertices. Upon conformational expansion of the capsid shell, the missing top layer is fulfilled by cementing the gpD protein against the internal pressure of DNA packaging. Our structures illuminate the assembly mechanisms of dsDNA viruses. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_32005.map.gz emd_32005.map.gz | 70.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-32005-v30.xml emd-32005-v30.xml emd-32005.xml emd-32005.xml | 12.6 KB 12.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_32005_fsc.xml emd_32005_fsc.xml | 25.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_32005.png emd_32005.png | 159.6 KB | ||
| Filedesc metadata |  emd-32005.cif.gz emd-32005.cif.gz | 5.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-32005 http://ftp.pdbj.org/pub/emdb/structures/EMD-32005 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-32005 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-32005 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_32005_validation.pdf.gz emd_32005_validation.pdf.gz | 347.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_32005_full_validation.pdf.gz emd_32005_full_validation.pdf.gz | 347.5 KB | 表示 | |
| XML形式データ |  emd_32005_validation.xml.gz emd_32005_validation.xml.gz | 19.9 KB | 表示 | |
| CIF形式データ |  emd_32005_validation.cif.gz emd_32005_validation.cif.gz | 28.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32005 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32005 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32005 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32005 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_32005.map.gz / 形式: CCP4 / 大きさ: 1.4 GB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_32005.map.gz / 形式: CCP4 / 大きさ: 1.4 GB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.30654 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Escherichia virus Lambda
| 全体 | 名称:  Escherichia virus Lambda (ウイルス) Escherichia virus Lambda (ウイルス) |
|---|---|
| 要素 |
|
-超分子 #1: Escherichia virus Lambda
| 超分子 | 名称: Escherichia virus Lambda / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: all / NCBI-ID: 10710 / 生物種: Escherichia virus Lambda / ウイルスタイプ: VIRION / ウイルス・単離状態: OTHER / ウイルス・エンベロープ: No / ウイルス・中空状態: Yes |
|---|
-分子 #1: Major capsid protein
| 分子 | 名称: Major capsid protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 7 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Escherichia phage lambda (λファージ) Escherichia phage lambda (λファージ) |
| 分子量 | 理論値: 38.22916 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSMYTTAQLL AANEQKFKFD PLFLRLFFRE SYPFTTEKVY LSQIPGLVNM ALYVSPIVSG EVIRSRGGST SEFTPGYVKP KHEVNPQMT LRRLPDEDPQ NLADPAYRRR RIIMQNMRDE ELAIAQVEEM QAVSAVLKGK YTMTGEAFDP VEVDMGRSEE N NITQSGGT ...文字列: MSMYTTAQLL AANEQKFKFD PLFLRLFFRE SYPFTTEKVY LSQIPGLVNM ALYVSPIVSG EVIRSRGGST SEFTPGYVKP KHEVNPQMT LRRLPDEDPQ NLADPAYRRR RIIMQNMRDE ELAIAQVEEM QAVSAVLKGK YTMTGEAFDP VEVDMGRSEE N NITQSGGT EWSKRDKSTY DPTDDIEAYA LNASGVVNII VFDPKGWALF RSFKAVKEKL DTRRGSNSEL ETAVKDLGKA VS YKGMYGD VAIVVYSGQY VENGVKKNFL PDNTMVLGNT QARGLRTYGC IQDADAQREG INASARYPKN WVTTGDPARE FTM IQSAPL MLLADPDEFV SVQLA UniProtKB: Major capsid protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: NITROGEN |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源: LAB6 |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー



 UCSF Chimera
UCSF Chimera
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)