+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Pseudomonas phage E217 contracted sheath | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Pseudomonas / phage / E217 / capsid / decorating proteins / VIRUS | |||||||||
| 機能・相同性 | Protein of unknown function DUF3383 / Protein of unknown function (DUF3383) / Tail sheath protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Pseudomonas phage vB_PaeM_E217 (ファージ) Pseudomonas phage vB_PaeM_E217 (ファージ) | |||||||||
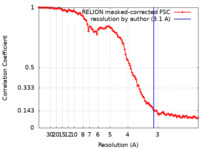
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | |||||||||
 データ登録者 データ登録者 | Li F / Cingolani G / Hou C | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: High-resolution cryo-EM structure of the Pseudomonas bacteriophage E217. 著者: Fenglin Li / Chun-Feng David Hou / Ravi K Lokareddy / Ruoyu Yang / Francesca Forti / Federica Briani / Gino Cingolani /   要旨: E217 is a Pseudomonas phage used in an experimental cocktail to eradicate cystic fibrosis-associated Pseudomonas aeruginosa. Here, we describe the structure of the whole E217 virion before and after ...E217 is a Pseudomonas phage used in an experimental cocktail to eradicate cystic fibrosis-associated Pseudomonas aeruginosa. Here, we describe the structure of the whole E217 virion before and after DNA ejection at 3.1 Å and 4.5 Å resolution, respectively, determined using cryogenic electron microscopy (cryo-EM). We identify and build de novo structures for 19 unique E217 gene products, resolve the tail genome-ejection machine in both extended and contracted states, and decipher the complete architecture of the baseplate formed by 66 polypeptide chains. We also determine that E217 recognizes the host O-antigen as a receptor, and we resolve the N-terminal portion of the O-antigen-binding tail fiber. We propose that E217 design principles presented in this paper are conserved across PB1-like Myoviridae phages of the Pbunavirus genus that encode a ~1.4 MDa baseplate, dramatically smaller than the coliphage T4. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29486.map.gz emd_29486.map.gz | 79.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29486-v30.xml emd-29486-v30.xml emd-29486.xml emd-29486.xml | 14.4 KB 14.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29486_fsc.xml emd_29486_fsc.xml | 10.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29486.png emd_29486.png | 191.4 KB | ||
| Filedesc metadata |  emd-29486.cif.gz emd-29486.cif.gz | 5.1 KB | ||
| その他 |  emd_29486_half_map_1.map.gz emd_29486_half_map_1.map.gz emd_29486_half_map_2.map.gz emd_29486_half_map_2.map.gz | 79.2 MB 79.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29486 http://ftp.pdbj.org/pub/emdb/structures/EMD-29486 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29486 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29486 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29486_validation.pdf.gz emd_29486_validation.pdf.gz | 1.4 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29486_full_validation.pdf.gz emd_29486_full_validation.pdf.gz | 1.4 MB | 表示 | |
| XML形式データ |  emd_29486_validation.xml.gz emd_29486_validation.xml.gz | 17.6 KB | 表示 | |
| CIF形式データ |  emd_29486_validation.cif.gz emd_29486_validation.cif.gz | 22.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29486 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29486 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29486 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29486 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29486.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29486.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.12 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_29486_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
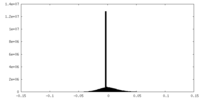
| 投影像・断面図 |
| ||||||||||||
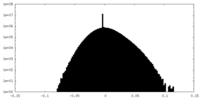
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_29486_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
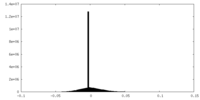
| 投影像・断面図 |
| ||||||||||||
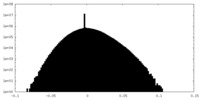
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Pseudomonas phage vB_PaeM_E217
| 全体 | 名称:  Pseudomonas phage vB_PaeM_E217 (ファージ) Pseudomonas phage vB_PaeM_E217 (ファージ) |
|---|---|
| 要素 |
|
-超分子 #1: Pseudomonas phage vB_PaeM_E217
| 超分子 | 名称: Pseudomonas phage vB_PaeM_E217 / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: all / NCBI-ID: 2034346 / 生物種: Pseudomonas phage vB_PaeM_E217 / ウイルスタイプ: VIRION / ウイルス・単離状態: OTHER / ウイルス・エンベロープ: Yes / ウイルス・中空状態: Yes |
|---|
-分子 #1: Sheath protein gp31
| 分子 | 名称: Sheath protein gp31 / タイプ: protein_or_peptide / ID: 1 / 詳細: contracted state / コピー数: 13 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Pseudomonas phage vB_PaeM_E217 (ファージ) Pseudomonas phage vB_PaeM_E217 (ファージ) |
| 分子量 | 理論値: 53.680723 KDa |
| 配列 | 文字列: MISQSRYIRI ISGVGAGAPV AGRKLILRVM TTNNVIPPGI VIEFDNANAV LSYFGAQSEE YQRAAAYFKF ISKSVNSPSS ISFARWVNT AIAPMVVGDN LPKTIADFAG FSAGVLTIMV GAAEQNITAI DTSAATSMDN VASIIQTEIR KNADPQLAQA T VTWNQNTN ...文字列: MISQSRYIRI ISGVGAGAPV AGRKLILRVM TTNNVIPPGI VIEFDNANAV LSYFGAQSEE YQRAAAYFKF ISKSVNSPSS ISFARWVNT AIAPMVVGDN LPKTIADFAG FSAGVLTIMV GAAEQNITAI DTSAATSMDN VASIIQTEIR KNADPQLAQA T VTWNQNTN QFTLVGATIG TGVLAVAKSA DPQDMSTALG WSTSNVVNVA GQSADLPDAA VAKSTNVSNN FGSFLFAGAP LD NDQIKAV SAWNAAQNNQ FIYTVATSLA NLGTLFTLVN GNAGTALNVL SATAANDFVE QCPSEILAAT NYDEPGASQN YMY YQFPGR NITVSDDTVA NTVDKSRGNY IGVTQANGQQ LAFYQRGILC GGPTDAVDMN VYANEIWLKS AIAQALLDLF LNVN AVPAS STGEAMTLAV LQPVLDKATA NGTFTYGKEI SAVQQQYITQ VTGDRRAWRQ VQTLGYWINI TFSSYTNSNT GLTEW KANY TLIYSKGDAI RFVEGSDVMI UniProtKB: Tail sheath protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: OTHER / 撮影モード: OTHER / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 81000 |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)