+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-21306 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM map of the C-terminal half of Leucine Rich Repeat Kinase 2 as a monomer at 8.1 angstroms | ||||||||||||
 マップデータ マップデータ | 8.1A map of a Leucine Rich Repeat Kinase 2 truncate as a monomer | ||||||||||||
 試料 試料 |
| ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 8.1 Å | ||||||||||||
 データ登録者 データ登録者 | Leschziner A / Deniston C / Lahiri I | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2020 ジャーナル: Nature / 年: 2020タイトル: Structure of LRRK2 in Parkinson's disease and model for microtubule interaction. 著者: C K Deniston / J Salogiannis / S Mathea / D M Snead / I Lahiri / M Matyszewski / O Donosa / R Watanabe / J Böhning / A K Shiau / S Knapp / E Villa / S L Reck-Peterson / A E Leschziner /     要旨: Leucine-rich repeat kinase 2 (LRRK2) is the most commonly mutated gene in familial Parkinson's disease and is also linked to its idiopathic form. LRRK2 has been proposed to function in membrane ...Leucine-rich repeat kinase 2 (LRRK2) is the most commonly mutated gene in familial Parkinson's disease and is also linked to its idiopathic form. LRRK2 has been proposed to function in membrane trafficking and colocalizes with microtubules. Despite the fundamental importance of LRRK2 for understanding and treating Parkinson's disease, structural information on the enzyme is limited. Here we report the structure of the catalytic half of LRRK2, and an atomic model of microtubule-associated LRRK2 built using a reported cryo-electron tomography in situ structure. We propose that the conformation of the LRRK2 kinase domain regulates its interactions with microtubules, with a closed conformation favouring oligomerization on microtubules. We show that the catalytic half of LRRK2 is sufficient for filament formation and blocks the motility of the microtubule-based motors kinesin 1 and cytoplasmic dynein 1 in vitro. Kinase inhibitors that stabilize an open conformation relieve this interference and reduce the formation of LRRK2 filaments in cells, whereas inhibitors that stabilize a closed conformation do not. Our findings suggest that LRRK2 can act as a roadblock for microtubule-based motors and have implications for the design of therapeutic LRRK2 kinase inhibitors. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_21306.map.gz emd_21306.map.gz | 9.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-21306-v30.xml emd-21306-v30.xml emd-21306.xml emd-21306.xml | 21.9 KB 21.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
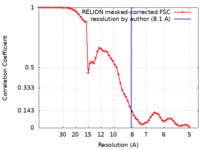
| FSC (解像度算出) |  emd_21306_fsc.xml emd_21306_fsc.xml | 6.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_21306.png emd_21306.png | 94.2 KB | ||
| その他 |  emd_21306_additional.map.gz emd_21306_additional.map.gz emd_21306_additional_1.map.gz emd_21306_additional_1.map.gz emd_21306_half_map_1.map.gz emd_21306_half_map_1.map.gz emd_21306_half_map_2.map.gz emd_21306_half_map_2.map.gz | 18.3 MB 18.3 MB 18 MB 18 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-21306 http://ftp.pdbj.org/pub/emdb/structures/EMD-21306 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21306 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21306 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_21306_validation.pdf.gz emd_21306_validation.pdf.gz | 508 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_21306_full_validation.pdf.gz emd_21306_full_validation.pdf.gz | 507.5 KB | 表示 | |
| XML形式データ |  emd_21306_validation.xml.gz emd_21306_validation.xml.gz | 11.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21306 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21306 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21306 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21306 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_21306.map.gz / 形式: CCP4 / 大きさ: 19.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_21306.map.gz / 形式: CCP4 / 大きさ: 19.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 8.1A map of a Leucine Rich Repeat Kinase 2 truncate as a monomer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.32 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: Sharpened 8.1A map of a Leucine Rich Repeat...
| ファイル | emd_21306_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened 8.1A map of a Leucine Rich Repeat Kinase 2 truncate as a monomer | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
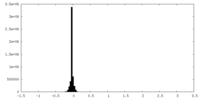
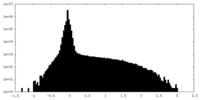
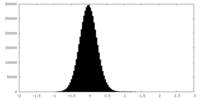
| 密度ヒストグラム |
-追加マップ: Sharpened 8.1A map of a Leucine Rich Repeat...
| ファイル | emd_21306_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened 8.1A map of a Leucine Rich Repeat Kinase 2 truncate as a monomer | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
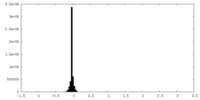
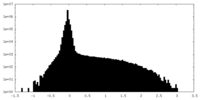
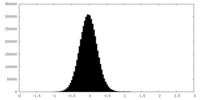
| 密度ヒストグラム |
-ハーフマップ: Half map 2
| ファイル | emd_21306_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
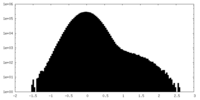
| 密度ヒストグラム |
-ハーフマップ: Half map 1
| ファイル | emd_21306_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
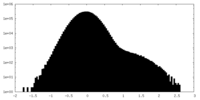
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : C-terminal half of monomeric Leucine Rich Repeat Kinase 2 (LRRK2)
| 全体 | 名称: C-terminal half of monomeric Leucine Rich Repeat Kinase 2 (LRRK2) |
|---|---|
| 要素 |
|
-超分子 #1: C-terminal half of monomeric Leucine Rich Repeat Kinase 2 (LRRK2)
| 超分子 | 名称: C-terminal half of monomeric Leucine Rich Repeat Kinase 2 (LRRK2) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: C-terminal half consists of residue 1327 to C-terminus. |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 分子量 | 理論値: 137 KDa |
-分子 #1: Leucine Rich Repeat Kinase 2
| 分子 | 名称: Leucine Rich Repeat Kinase 2 / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO / EC番号: non-specific serine/threonine protein kinase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: KKAVPYNRMK LMIVGNTGSG KTTLLQQLMK TKKSDLGMQS ATVGIDVKDW PIQIRDKRKR DLVLNVWDFA GREE FYSTH PHFMTQRALY LAVYDLSKGQ AEVDAMKPWL FNIKARASSS PVILVGTHLD VSDEKQRKAC MSKIT KELL NKRGFPAIRD YHFVNATEES ...文字列: KKAVPYNRMK LMIVGNTGSG KTTLLQQLMK TKKSDLGMQS ATVGIDVKDW PIQIRDKRKR DLVLNVWDFA GREE FYSTH PHFMTQRALY LAVYDLSKGQ AEVDAMKPWL FNIKARASSS PVILVGTHLD VSDEKQRKAC MSKIT KELL NKRGFPAIRD YHFVNATEES DALAKLRKTI INESLNFKIR DQLVVGQLIP DCYVELEKII LSERKN VPI EFPVIDRKRL LQLVRENQLQ LDENELPHAV HFLNESGVLL HFQDPALQLS DLYFVEPKWL CKIMAQI LT VKVEGCPKHP KGIISRRDVE KFLSKKRKFP KNYMSQYFKL LEKFQIALPI GEEYLLVPSS LSDHRPVI E LPHCENSEII IRLYEMPYFP MGFWSRLINR LLEISPYMLS GRERALRPNR MYWRQGIYLN WSPEAYCLV GSEVLDNHPE SFLKITVPSC RKGCILLGQV VDHIDSLMEE WFPGLLEIDI CGEGETLLKK WALYSFNDGE EHQKILLDD LMKKAEEGDL LVNPDQPRLT IPISQIAPDL ILADLPRNIM LNNDELEFEQ APEFLLGDGS F GSVYRAAY EGEEVAVKIF NKHTSLRLLR QELVVLCHLH HPSLISLLAA GIRPRMLVME LASKGSLDRL LQ QDKASLT RTLQHRIALH VADGLRYLHS AMIIYRDLKP HNVLLFTLYP NAAIIAKIAD YGIAQYCCRM GIK TSEGTP GFRAPEVARG NVIYNQQADV YSFGLLLYDI LTTGGRIVEG LKFPNEFDEL EIQGKLPDPV KEYG CAPWP MVEKLIKQCL KENPQERPTS AQVFDILNSA ELVCLTRRIL LPKNVIVECM VATHHNSRNA SIWLG CGHT DRGQLSFLDL NTEGYTSEEV ADSRILCLAL VHLPVEKESW IVSGTQSGTL LVINTEDGKK RHTLEK MTD SVTCLYCNSF SKQSKQKNFL LVGTADGKLA IFEDKTVKLK GAAPLKILNI GNVSTPLMCL SESTNST ER NVMWGGCGTK IFSFSNDFTI QKLIETRTSQ LFSYAAFSDS NIITVVVDTA LYIAKQNSPV VEVWDKKT E KLCGLIDCVH FLREVMVKEN KESKHKMSYS GRVKTLCLQK NTALWIGTGG GHILLLDLST RRLIRVIYN FCNSVRVMMT AQLGSLKNVM LVLGYNRKNT EGTQKQKEIQ SCLTVWDINL PHEVQNLEKH IEVRKELAEK MRRTSVE |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
| |||||||||||||||||||||
| グリッド | モデル: Quantifoil, UltrAuFoil, R1.2/1.3 / 材質: COPPER/RHODIUM / 前処理 - タイプ: GLOW DISCHARGE | |||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK II | |||||||||||||||||||||
| 詳細 | This sample was imaged over a number of datasets. Specimen concentrations ranged from 0.14(1uM)-0.84(6uM) mg/mL, however the average was 0.5 and thus was entered as the reported specimen concentration. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 詳細 | Datasets imaged at 36kx, either counting or super resolution mode) magnifications were collected. One dataset collected at 30 degree tilt. |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 実像数: 7067 / 平均電子線量: 4.2 e/Å2 詳細: Datasets collected at 36kx, either counting or super resolution mod,) magnifications were collected. Only a single dose has been entered, however datasets were collected at various doses ...詳細: Datasets collected at 36kx, either counting or super resolution mod,) magnifications were collected. Only a single dose has been entered, however datasets were collected at various doses between 4.2 and 10 electrons per angstrom squared. See method section of paper for more details. |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)