登録情報 データベース : EMDB / ID : EMD-13974タイトル Desensitized state of GluA1/2 AMPA receptor in complex with TARP-gamma 8 (LBD) Postprocessed map obtained after focused refinement of the LBD region of the complex GluA1/2/TARP8 in desensitised state 複合体 : Complex between GluA1/2 AMPA receptor and auxiliary subunit TARP gamma8タンパク質・ペプチド : GluA1 AMPA glutamate receptor 1, Flip isoformタンパク質・ペプチド : AMPA Glutamate Receptor 2, flip isoform, Q/R editedタンパク質・ペプチド : TARP-gamma 8 / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
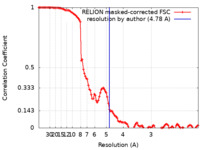
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Rattus norvegicus (ドブネズミ)手法 / / 解像度 : 4.78 Å Herguedas B / Kohegyi B / Dohrke JN / Watson JF / Zhang D / Ho H / Shaikh SH / Lape R / Krieger JM / Greger IH 資金援助 Organization Grant number 国 Medical Research Council (MRC, United Kingdom) MC_U105174197 Biotechnology and Biological Sciences Research Council (BBSRC) BB/N002113/1 Spanish Ministry of Science, Innovation, and Universities PID2019-106284GA-I00
ジャーナル : Nat Commun / 年 : 2022タイトル : Mechanisms underlying TARP modulation of the GluA1/2-γ8 AMPA receptor.著者 : Beatriz Herguedas / Bianka K Kohegyi / Jan-Niklas Dohrke / Jake F Watson / Danyang Zhang / Hinze Ho / Saher A Shaikh / Remigijus Lape / James M Krieger / Ingo H Greger / 要旨 : AMPA-type glutamate receptors (AMPARs) mediate rapid signal transmission at excitatory synapses in the brain. Glutamate binding to the receptor's ligand-binding domains (LBDs) leads to ion channel ... AMPA-type glutamate receptors (AMPARs) mediate rapid signal transmission at excitatory synapses in the brain. Glutamate binding to the receptor's ligand-binding domains (LBDs) leads to ion channel activation and desensitization. Gating kinetics shape synaptic transmission and are strongly modulated by transmembrane AMPAR regulatory proteins (TARPs) through currently incompletely resolved mechanisms. Here, electron cryo-microscopy structures of the GluA1/2 TARP-γ8 complex, in both open and desensitized states (at 3.5 Å), reveal state-selective engagement of the LBDs by the large TARP-γ8 loop ('β1'), elucidating how this TARP stabilizes specific gating states. We further show how TARPs alter channel rectification, by interacting with the pore helix of the selectivity filter. Lastly, we reveal that the Q/R-editing site couples the channel constriction at the filter entrance to the gate, and forms the major cation binding site in the conduction path. Our results provide a mechanistic framework of how TARPs modulate AMPAR gating and conductance. 履歴 登録 2021年12月12日 - ヘッダ(付随情報) 公開 2022年2月23日 - マップ公開 2022年2月23日 - 更新 2023年12月13日 - 現状 2023年12月13日 処理サイト : PDBe / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 データ登録者
データ登録者 英国, 3件
英国, 3件  引用
引用 ジャーナル: Nat Commun / 年: 2022
ジャーナル: Nat Commun / 年: 2022



 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_13974.map.gz
emd_13974.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-13974-v30.xml
emd-13974-v30.xml emd-13974.xml
emd-13974.xml EMDBヘッダ
EMDBヘッダ emd_13974_fsc.xml
emd_13974_fsc.xml FSCデータファイル
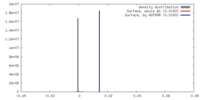
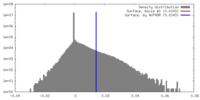
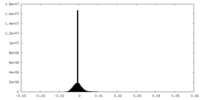
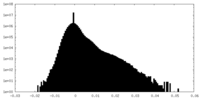
FSCデータファイル emd_13974.png
emd_13974.png emd-13974.cif.gz
emd-13974.cif.gz emd_13974_half_map_1.map.gz
emd_13974_half_map_1.map.gz emd_13974_half_map_2.map.gz
emd_13974_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-13974
http://ftp.pdbj.org/pub/emdb/structures/EMD-13974 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13974
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13974 emd_13974_validation.pdf.gz
emd_13974_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_13974_full_validation.pdf.gz
emd_13974_full_validation.pdf.gz emd_13974_validation.xml.gz
emd_13974_validation.xml.gz emd_13974_validation.cif.gz
emd_13974_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13974
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13974 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13974
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13974 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_13974.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_13974.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素

 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト) 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 画像解析
画像解析 ムービー
ムービー コントローラー
コントローラー

























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)