+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-11196 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | bovine ATP synthase rotor domain state 2 | |||||||||
 マップデータ マップデータ | State 2 rotor main map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ATP synthase / mitochondria / mammalian / complex / HYDROLASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Formation of ATP by chemiosmotic coupling / Cristae formation / mitochondrial proton-transporting ATP synthase complex assembly / mitochondrial envelope / Mitochondrial protein degradation / proton-transporting ATP synthase complex / proton transmembrane transporter activity / proton motive force-driven ATP synthesis / : / proton motive force-driven mitochondrial ATP synthesis ...Formation of ATP by chemiosmotic coupling / Cristae formation / mitochondrial proton-transporting ATP synthase complex assembly / mitochondrial envelope / Mitochondrial protein degradation / proton-transporting ATP synthase complex / proton transmembrane transporter activity / proton motive force-driven ATP synthesis / : / proton motive force-driven mitochondrial ATP synthesis / : / proton-transporting ATP synthase activity, rotational mechanism / proton transmembrane transport / aerobic respiration / mitochondrial membrane / mitochondrial inner membrane / lipid binding / structural molecule activity / mitochondrion 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
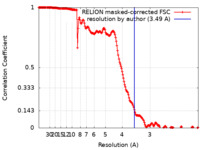
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.49 Å | |||||||||
 データ登録者 データ登録者 | Spikes T / Montgomery MG | |||||||||
| 資金援助 |  英国, 2件 英国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2020 ジャーナル: Proc Natl Acad Sci U S A / 年: 2020タイトル: Structure of the dimeric ATP synthase from bovine mitochondria. 著者: Tobias E Spikes / Martin G Montgomery / John E Walker /  要旨: The structure of the dimeric ATP synthase from bovine mitochondria determined in three rotational states by electron cryo-microscopy provides evidence that the proton uptake from the mitochondrial ...The structure of the dimeric ATP synthase from bovine mitochondria determined in three rotational states by electron cryo-microscopy provides evidence that the proton uptake from the mitochondrial matrix via the proton inlet half channel proceeds via a Grotthus mechanism, and a similar mechanism may operate in the exit half channel. The structure has given information about the architecture and mechanical constitution and properties of the peripheral stalk, part of the membrane extrinsic region of the stator, and how the action of the peripheral stalk damps the side-to-side rocking motions that occur in the enzyme complex during the catalytic cycle. It also describes wedge structures in the membrane domains of each monomer, where the skeleton of each wedge is provided by three α-helices in the membrane domains of the b-subunit to which the supernumerary subunits e, f, and g and the membrane domain of subunit A6L are bound. Protein voids in the wedge are filled by three specifically bound cardiolipin molecules and two other phospholipids. The external surfaces of the wedges link the monomeric complexes together into the dimeric structures and provide a pivot to allow the monomer-monomer interfaces to change during catalysis and to accommodate other changes not related directly to catalysis in the monomer-monomer interface that occur in mitochondrial cristae. The structure of the bovine dimer also demonstrates that the structures of dimeric ATP synthases in a tetrameric porcine enzyme have been seriously misinterpreted in the membrane domains. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_11196.map.gz emd_11196.map.gz | 442.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-11196-v30.xml emd-11196-v30.xml emd-11196.xml emd-11196.xml | 29.7 KB 29.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_11196_fsc.xml emd_11196_fsc.xml | 17.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_11196.png emd_11196.png | 45.7 KB | ||
| マスクデータ |  emd_11196_msk_1.map emd_11196_msk_1.map | 476.8 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-11196.cif.gz emd-11196.cif.gz | 7 KB | ||
| その他 |  emd_11196_half_map_1.map.gz emd_11196_half_map_1.map.gz emd_11196_half_map_2.map.gz emd_11196_half_map_2.map.gz | 383.3 MB 383.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-11196 http://ftp.pdbj.org/pub/emdb/structures/EMD-11196 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11196 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11196 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6zg8MC  6yy0C  6z1rC  6z1uC  6zbbC  6zg7C  6zikC  6ziqC  6zitC  6ziuC  6zmrC  6znaC  6zpoC  6zqmC  6zqnC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_11196.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_11196.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | State 2 rotor main map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.048 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_11196_msk_1.map emd_11196_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: State 2 rotor half map 1
| ファイル | emd_11196_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | State 2 rotor half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: State 2 rotor half map 2
| ファイル | emd_11196_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | State 2 rotor half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : bovine dimeric ATP synthase
| 全体 | 名称: bovine dimeric ATP synthase |
|---|---|
| 要素 |
|
-超分子 #1: bovine dimeric ATP synthase
| 超分子 | 名称: bovine dimeric ATP synthase / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 112 KDa |
-超分子 #2: bovine ATP synthase rotor domain state 2
| 超分子 | 名称: bovine ATP synthase rotor domain state 2 / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: ATP synthase subunit gamma, mitochondrial
| 分子 | 名称: ATP synthase subunit gamma, mitochondrial / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 30.30076 KDa |
| 配列 | 文字列: ATLKDITRRL KSIKNIQKIT KSMKMVAAAK YARAERELKP ARVYGVGSLA LYEKADIKTP EDKKKHLIIG VSSDRGLCGA IHSSVAKQM KSEAANLAAA GKEVKIIGVG DKIRSILHRT HSDQFLVTFK EVGRRPPTFG DASVIALELL NSGYEFDEGS I IFNRFRSV ...文字列: ATLKDITRRL KSIKNIQKIT KSMKMVAAAK YARAERELKP ARVYGVGSLA LYEKADIKTP EDKKKHLIIG VSSDRGLCGA IHSSVAKQM KSEAANLAAA GKEVKIIGVG DKIRSILHRT HSDQFLVTFK EVGRRPPTFG DASVIALELL NSGYEFDEGS I IFNRFRSV ISYKTEEKPI FSLDTISSAE SMSIYDDIDA DVLRNYQEYS LANIIYYSLK ESTTSEQSAR MTAMDNASKN AS EMIDKLT LTFNRTRQAV ITKELIEIIS GAAALD UniProtKB: ATP synthase F(1) complex subunit gamma, mitochondrial |
-分子 #2: ATP synthase subunit delta, mitochondrial
| 分子 | 名称: ATP synthase subunit delta, mitochondrial / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 15.074813 KDa |
| 配列 | 文字列: AEAAAAQAPA AGPGQMSFTF ASPTQVFFNS ANVRQVDVPT QTGAFGILAA HVPTLQVLRP GLVVVHAEDG TTSKYFVSSG SVTVNADSS VQLLAEEAVT LDMLDLGAAK ANLEKAQSEL LGAADEATRA EIQIRIEANE ALVKALE UniProtKB: ATP synthase F(1) complex subunit delta, mitochondrial |
-分子 #3: ATP synthase subunit epsilon, mitochondrial
| 分子 | 名称: ATP synthase subunit epsilon, mitochondrial / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 5.662693 KDa |
| 配列 | 文字列: VAYWRQAGLS YIRYSQICAK AVRDALKTEF KANAMKTSGS TIKIVKVKKE UniProtKB: ATP synthase F(1) complex subunit epsilon, mitochondrial |
-分子 #4: ATP synthase F(0) complex subunit C2, mitochondrial
| 分子 | 名称: ATP synthase F(0) complex subunit C2, mitochondrial / タイプ: protein_or_peptide / ID: 4 詳細: residue 43 is tri-methyl lysine. A post translational modification コピー数: 8 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 7.653034 KDa |
| 配列 | 文字列: DIDTAAKFIG AGAATVGVAG SGAGIGTVFG SLIIGYARNP SL(M3L)QQLFSYA ILGFALSEAM GLFCLMVAFL ILFAM UniProtKB: ATP synthase F(0) complex subunit C2, mitochondrial |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 |
| グリッド | モデル: UltrAuFoil / 材質: GOLD / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: OTHER 詳細: Post glow-discharging, the grids were PEGylated with 5 mM mercaptopoly(ethylene glycol)carboxylic acid (PEGthiol) |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 294 K / 装置: FEI VITROBOT MARK IV 詳細: The sample was allowed to penetrate through the holes support and to distribute to both sides of the grid surface for ~15 sec. Then the grids were blotted with filter paper for 8-10 sec before blotting.. |
| 詳細 | Nickel affinity purified followed by gel filtration |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: COUNTING / 平均露光時間: 12.0 sec. / 平均電子線量: 4.6 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT | ||||||||||||||||||||||||
| 得られたモデル |  PDB-6zg8: |
 ムービー
ムービー コントローラー
コントローラー

























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)