+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-11165 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Coxsackievirus B4 in complex with capsid binder compound 48 | |||||||||
 マップデータ マップデータ | Coxsackievirus B4 in complex with capsid binder compound 48 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Enterovirus / Coxsackievirus B4 / Inhibitor / Capsid Binder / VIRUS | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of RIG-I activity / picornain 2A / symbiont-mediated suppression of host mRNA export from nucleus / symbiont genome entry into host cell via pore formation in plasma membrane / picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane / nucleoside-triphosphate phosphatase / channel activity / monoatomic ion transmembrane transport ...symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of RIG-I activity / picornain 2A / symbiont-mediated suppression of host mRNA export from nucleus / symbiont genome entry into host cell via pore formation in plasma membrane / picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane / nucleoside-triphosphate phosphatase / channel activity / monoatomic ion transmembrane transport / DNA replication / RNA helicase activity / endocytosis involved in viral entry into host cell / symbiont-mediated activation of host autophagy / RNA-directed RNA polymerase / cysteine-type endopeptidase activity / viral RNA genome replication / RNA-directed RNA polymerase activity / DNA-templated transcription / virion attachment to host cell / host cell nucleus / structural molecule activity / ATP hydrolysis activity / proteolysis / RNA binding / zinc ion binding / ATP binding / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Coxsackievirus B4 (strain E2) (コクサッキーウイルス) Coxsackievirus B4 (strain E2) (コクサッキーウイルス) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.7 Å | |||||||||
 データ登録者 データ登録者 | Flatt JW / Domanska A | |||||||||
| 資金援助 |  フィンランド, 2件 フィンランド, 2件
| |||||||||
 引用 引用 |  ジャーナル: Commun Biol / 年: 2021 ジャーナル: Commun Biol / 年: 2021タイトル: Identification of a conserved virion-stabilizing network inside the interprotomer pocket of enteroviruses. 著者: Justin W Flatt / Aušra Domanska / Alma L Seppälä / Sarah J Butcher /  要旨: Enteroviruses pose a persistent and widespread threat to human physical health, with no specific treatments available. Small molecule capsid binders have the potential to be developed as antivirals ...Enteroviruses pose a persistent and widespread threat to human physical health, with no specific treatments available. Small molecule capsid binders have the potential to be developed as antivirals that prevent virus attachment and entry into host cells. To aid with broad-range drug development, we report here structures of coxsackieviruses B3 and B4 bound to different interprotomer-targeting capsid binders using single-particle cryo-EM. The EM density maps are beyond 3 Å resolution, providing detailed information about interactions in the ligand-binding pocket. Comparative analysis revealed the residues that form a conserved virion-stabilizing network at the interprotomer site, and showed the small molecule properties that allow anchoring in the pocket to inhibit virus disassembly. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_11165.map.gz emd_11165.map.gz | 59 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-11165-v30.xml emd-11165-v30.xml emd-11165.xml emd-11165.xml | 15.1 KB 15.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_11165.png emd_11165.png | 243 KB | ||
| Filedesc metadata |  emd-11165.cif.gz emd-11165.cif.gz | 6.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-11165 http://ftp.pdbj.org/pub/emdb/structures/EMD-11165 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11165 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11165 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_11165_validation.pdf.gz emd_11165_validation.pdf.gz | 484.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_11165_full_validation.pdf.gz emd_11165_full_validation.pdf.gz | 484.1 KB | 表示 | |
| XML形式データ |  emd_11165_validation.xml.gz emd_11165_validation.xml.gz | 7.3 KB | 表示 | |
| CIF形式データ |  emd_11165_validation.cif.gz emd_11165_validation.cif.gz | 8.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11165 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11165 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11165 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11165 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6zckMC  6zclC  6zmsC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10652 (タイトル: Identification of a conserved virion-stabilizing network inside the interprotomer pocket of enteroviruses EMPIAR-10652 (タイトル: Identification of a conserved virion-stabilizing network inside the interprotomer pocket of enterovirusesData size: 7.3 TB Data #1: Unaligned multiframe micrographs of CVB4 in complex with CP48 [micrographs - multiframe] Data #2: Aligned multi-frame micrographs dose weighted [micrographs - single frame] Data #3: Aligned non dose weighted micrographs [micrographs - single frame] Data #4: Un-aligned multiframe micrographs of CVB4 control [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_11165.map.gz / 形式: CCP4 / 大きさ: 282.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_11165.map.gz / 形式: CCP4 / 大きさ: 282.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Coxsackievirus B4 in complex with capsid binder compound 48 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Coxsackievirus B4 (strain E2)
| 全体 | 名称:  Coxsackievirus B4 (strain E2) (コクサッキーウイルス) Coxsackievirus B4 (strain E2) (コクサッキーウイルス) |
|---|---|
| 要素 |
|
-超分子 #1: Coxsackievirus B4 (strain E2)
| 超分子 | 名称: Coxsackievirus B4 (strain E2) / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 詳細: Virus harvested in BGM cells and purified in CsCl gradient. NCBI-ID: 103905 / 生物種: Coxsackievirus B4 (strain E2) / ウイルスタイプ: VIRION / ウイルス・単離状態: STRAIN / ウイルス・エンベロープ: No / ウイルス・中空状態: No |
|---|---|
| 宿主 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| ウイルス殻 | Shell ID: 1 / 名称: Icosahedron / 直径: 300.0 Å / T番号(三角分割数): 3 |
-分子 #1: Capsid protein VP1
| 分子 | 名称: Capsid protein VP1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Coxsackievirus B4 (strain E2) (コクサッキーウイルス) Coxsackievirus B4 (strain E2) (コクサッキーウイルス)株: E2 |
| 分子量 | 理論値: 30.685498 KDa |
| 配列 | 文字列: MGRVADTIAR GPSNSEQIPA LTAVETGHTS QVDPSDTMQT RHVHNYHSRS ESSIENFLCR SACVIYIKYS SAESNNLKRY AEWVINTRQ VAQLRRKMEM FTYIRCDMEL TFVITSHQEM STATNSDVPV QTHQIMYVPP GGPVPTSVND YVWQTSTNPS I FWTEGNAP ...文字列: MGRVADTIAR GPSNSEQIPA LTAVETGHTS QVDPSDTMQT RHVHNYHSRS ESSIENFLCR SACVIYIKYS SAESNNLKRY AEWVINTRQ VAQLRRKMEM FTYIRCDMEL TFVITSHQEM STATNSDVPV QTHQIMYVPP GGPVPTSVND YVWQTSTNPS I FWTEGNAP PRMSIPFMSI GNAYTMFYDG WSNFSRDGIY GYNSLNNMGT IYARHVNDSS PGGLTSTIRI YFKPKHVKAY VP RPPRLCQ YKKAKNVNFD VEAVTTERAS LVTT UniProtKB: Genome polyprotein |
-分子 #2: Capsid protein VP2
| 分子 | 名称: Capsid protein VP2 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Coxsackievirus B4 (strain E2) (コクサッキーウイルス) Coxsackievirus B4 (strain E2) (コクサッキーウイルス)株: E2 |
| 分子量 | 理論値: 27.70807 KDa |
| 配列 | 文字列: SDRVRSITLG NSTITTQECA NVVVGYGVWP DYLSDEEATA EDQPTQPDVA TCRFYTLNSV KWEMQSAGWW WKFPDALSEM GLFGQNMQY HYLGRSGYTI HVQCNASKFH QGCLLVVCVP EAEMGCTNAE NAPTYGDLCG GETAKQFEQN AVTGETAVQT A VCNAGMGV ...文字列: SDRVRSITLG NSTITTQECA NVVVGYGVWP DYLSDEEATA EDQPTQPDVA TCRFYTLNSV KWEMQSAGWW WKFPDALSEM GLFGQNMQY HYLGRSGYTI HVQCNASKFH QGCLLVVCVP EAEMGCTNAE NAPTYGDLCG GETAKQFEQN AVTGETAVQT A VCNAGMGV GVGNLTIYPH QWINLRTNNS ATIVMPYINS VPMDNMFRHN NFTLMIIPFA PLDYVTGASS YIPITVTVAP MS AEYNGLR LAGHQ UniProtKB: Genome polyprotein |
-分子 #3: Capsid protein VP3
| 分子 | 名称: Capsid protein VP3 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Coxsackievirus B4 (strain E2) (コクサッキーウイルス) Coxsackievirus B4 (strain E2) (コクサッキーウイルス)株: E2 |
| 分子量 | 理論値: 26.44416 KDa |
| 配列 | 文字列: GLPTMLTPGS TQFLTSDDFQ SPSAMPQFDV TPEMNIPGQV RNLMEIAEVD SVVPINNLQA NLKTMEAYRV QVRSTDEMGG QIFGFPLQP GASSVLQRTL LGEILNYYTH WSGSLKLTFV FCGSAMATGK FLLAYSPPGA GAPDSRKNAM LGTHVIWDVG L QSSCVLCV ...文字列: GLPTMLTPGS TQFLTSDDFQ SPSAMPQFDV TPEMNIPGQV RNLMEIAEVD SVVPINNLQA NLKTMEAYRV QVRSTDEMGG QIFGFPLQP GASSVLQRTL LGEILNYYTH WSGSLKLTFV FCGSAMATGK FLLAYSPPGA GAPDSRKNAM LGTHVIWDVG L QSSCVLCV PWISQTHYRY VVDDKYTASG FISCWYQTNV IVPAEAQKSC YIMCFVSACN DFSVRMLRDT QFIKQDTFYQ UniProtKB: Genome polyprotein |
-分子 #4: Capsid protein VP4
| 分子 | 名称: Capsid protein VP4 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Coxsackievirus B4 (strain E2) (コクサッキーウイルス) Coxsackievirus B4 (strain E2) (コクサッキーウイルス)株: E2 |
| 分子量 | 理論値: 7.499235 KDa |
| 配列 | 文字列: MGAQVSTQKT GAHETSLSAS GNSIIHYTNI NYYKDAASNS ANRQDFTQDP SKFTEPVKDV MIKSLPALN UniProtKB: Genome polyprotein |
-分子 #5: 4-[(6-propoxynaphthalen-2-yl)sulfonylamino]benzoic acid
| 分子 | 名称: 4-[(6-propoxynaphthalen-2-yl)sulfonylamino]benzoic acid タイプ: ligand / ID: 5 / コピー数: 1 / 式: QFW |
|---|---|
| 分子量 | 理論値: 385.434 Da |
| Chemical component information | 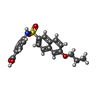 ChemComp-QFW: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7 構成要素:
| |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: PELCO Ultrathin Carbon with Lacey Carbon / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 45 sec. / 詳細: Ted Pella product No. 01824 | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / 装置: HOMEMADE PLUNGER | |||||||||||||||
| 詳細 | purified virus mixed with compound 48, incubated at room temperature for 30 minutes before plunging. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 47.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 0.6 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: INSILICO MODEL |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 2.7 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 3) / 使用した粒子像数: 13252 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















