+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8eg0 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
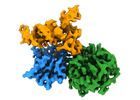
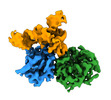
| タイトル | CryoEM structure of human METTL1-WDR4 in complex with Lys-tRNA and SAH | ||||||||||||
 要素 要素 |
| ||||||||||||
 キーワード キーワード | TRANSFERASE/RNA /  Cancer protein (悪性腫瘍) / Cancer protein (悪性腫瘍) /  Methyl transferase (メチルトランスフェラーゼ) / Methyl transferase (メチルトランスフェラーゼ) /  TRANSFERASE (転移酵素) / TRANSFERASE-RNA complex TRANSFERASE (転移酵素) / TRANSFERASE-RNA complex | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報internal mRNA (guanine-N7-)-methyltransferase activity / tRNA stabilization / tRNA (m7G46) methyltransferase complex / tRNA (guanine-N7)-methylation / RNA (guanine-N7)-methylation / tRNA (guanine46-N7)-methyltransferase / tRNA (guanine(46)-N7)-methyltransferase activity / tRNA methyltransferase activator activity / tRNA methyltransferase complex / tRNA modification in the nucleus and cytosol ...internal mRNA (guanine-N7-)-methyltransferase activity / tRNA stabilization / tRNA (m7G46) methyltransferase complex / tRNA (guanine-N7)-methylation / RNA (guanine-N7)-methylation / tRNA (guanine46-N7)-methyltransferase / tRNA (guanine(46)-N7)-methyltransferase activity / tRNA methyltransferase activator activity / tRNA methyltransferase complex / tRNA modification in the nucleus and cytosol / tRNA methylation / tRNA modification /  enzyme activator activity / enzyme activator activity /  転移酵素; 一炭素原子の基を移すもの; メチル基を移すもの / 転移酵素; 一炭素原子の基を移すもの; メチル基を移すもの /  染色体 / 染色体 /  tRNA binding / DNA damage response / tRNA binding / DNA damage response /  核小体 / 核小体 /  核質 / 核質 /  細胞核 / 細胞核 /  細胞質基質 細胞質基質類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.53 Å クライオ電子顕微鏡法 / 解像度: 3.53 Å | ||||||||||||
 データ登録者 データ登録者 | Ruiz-Arroyo, V.M. / Nam, Y. | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2023 ジャーナル: Nature / 年: 2023タイトル: Structures and mechanisms of tRNA methylation by METTL1-WDR4. 著者: Victor M Ruiz-Arroyo / Rishi Raj / Kesavan Babu / Otgonbileg Onolbaatar / Paul H Roberts / Yunsun Nam /  要旨: Specific, regulated modification of RNAs is important for proper gene expression. tRNAs are rich with various chemical modifications that affect their stability and function. 7-Methylguanosine (mG) ...Specific, regulated modification of RNAs is important for proper gene expression. tRNAs are rich with various chemical modifications that affect their stability and function. 7-Methylguanosine (mG) at tRNA position 46 is a conserved modification that modulates steady-state tRNA levels to affect cell growth. The METTL1-WDR4 complex generates mG46 in humans, and dysregulation of METTL1-WDR4 has been linked to brain malformation and multiple cancers. Here we show how METTL1 and WDR4 cooperate to recognize RNA substrates and catalyse methylation. A crystal structure of METTL1-WDR4 and cryo-electron microscopy structures of METTL1-WDR4-tRNA show that the composite protein surface recognizes the tRNA elbow through shape complementarity. The cryo-electron microscopy structures of METTL1-WDR4-tRNA with S-adenosylmethionine or S-adenosylhomocysteine along with METTL1 crystal structures provide additional insights into the catalytic mechanism by revealing the active site in multiple states. The METTL1 N terminus couples cofactor binding with conformational changes in the tRNA, the catalytic loop and the WDR4 C terminus, acting as the switch to activate mG methylation. Thus, our structural models explain how post-translational modifications of the METTL1 N terminus can regulate methylation. Together, our work elucidates the core and regulatory mechanisms underlying mG modification by METTL1, providing the framework to understand its contribution to biology and disease. #1:  ジャーナル: To be published ジャーナル: To be publishedタイトル: CryoEM structure of human METTL1-WDR4 in complex with Lys-tRNA 著者: Ruiz-Arroyo, V.M. / Nam, Y. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8eg0.cif.gz 8eg0.cif.gz | 172.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8eg0.ent.gz pdb8eg0.ent.gz | 111 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8eg0.json.gz 8eg0.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/eg/8eg0 https://data.pdbj.org/pub/pdb/validation_reports/eg/8eg0 ftp://data.pdbj.org/pub/pdb/validation_reports/eg/8eg0 ftp://data.pdbj.org/pub/pdb/validation_reports/eg/8eg0 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ | 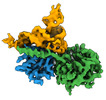 28108MC  8d58C  8d59C  8d5bC  8d9kC  8d9lC C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 45123.023 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: WDR4 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: WDR4 / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: P57081 Escherichia coli (大腸菌) / 参照: UniProt: P57081 |
|---|---|
| #2: タンパク質 | 分子量: 31516.012 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: METTL1, C12orf1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: METTL1, C12orf1 / 発現宿主:   Escherichia coli (大腸菌) Escherichia coli (大腸菌)参照: UniProt: Q9UBP6, tRNA (guanine46-N7)-methyltransferase,  転移酵素; 一炭素原子の基を移すもの; メチル基を移すもの 転移酵素; 一炭素原子の基を移すもの; メチル基を移すもの |
| #3: RNA鎖 | 分子量: 23162.705 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)   Homo sapiens (ヒト) / 参照: GenBank: 1781322811 Homo sapiens (ヒト) / 参照: GenBank: 1781322811 |
| #4: 化合物 | ChemComp-SAH /  S-アデノシル-L-ホモシステイン S-アデノシル-L-ホモシステイン |
| 研究の焦点であるリガンドがあるか | Y |
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Human METTL1-WDR4 in complex with Lys-tRNA and SAH. / タイプ: COMPLEX / Entity ID: #1-#3 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 0.112 MDa / 実験値: NO |
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 緩衝液 | pH: 7.5 |
| 試料 | 濃度: 3 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 |
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 375.15 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 700 nm Bright-field microscopy / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 700 nm |
| 撮影 | 電子線照射量: 62 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||
CTF補正 | タイプ: NONE | ||||||||||||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | ||||||||||||||||||||||||
3次元再構成 | 解像度: 3.53 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 71913 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 精密化 | 交差検証法: NONE 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2 | ||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 197.98 Å2 | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj































