+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8axl | ||||||
|---|---|---|---|---|---|---|---|
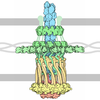
| タイトル | Outer membrane secretin pore of the type 3 secretion system of Shigella flexneri | ||||||
 要素 要素 | Outer membrane protein MxiD | ||||||
 キーワード キーワード | PROTEIN TRANSPORT / type 3 secretion / secretin / outer membrane ring / shigella / infection | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報type III protein secretion system complex / protein secretion by the type III secretion system / cell outer membrane 類似検索 - 分子機能 | ||||||
| 生物種 |  Shigella flexneri (フレクスナー赤痢菌) Shigella flexneri (フレクスナー赤痢菌) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.42 Å | ||||||
 データ登録者 データ登録者 | Lunelli, M. | ||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| ||||||
 引用 引用 |  ジャーナル: Protein Sci / 年: 2023 ジャーナル: Protein Sci / 年: 2023タイトル: Integrative structural analysis of the type III secretion system needle complex from Shigella flexneri. 著者: Lara Flacht / Michele Lunelli / Karol Kaszuba / Zhuo Angel Chen / Francis J O' Reilly / Juri Rappsilber / Jan Kosinski / Michael Kolbe /   要旨: The type III secretion system (T3SS) is a large, transmembrane protein machinery used by various pathogenic gram-negative bacteria to transport virulence factors into the host cell during infection. ...The type III secretion system (T3SS) is a large, transmembrane protein machinery used by various pathogenic gram-negative bacteria to transport virulence factors into the host cell during infection. Understanding the structure of T3SSs is crucial for future developments of therapeutics that could target this system. However, much of the knowledge about the structure of T3SS is available only for Salmonella, and it is unclear how this large assembly is conserved across species. Here, we combined cryo-electron microscopy, cross-linking mass spectrometry, and integrative modeling to determine the structure of the T3SS needle complex from Shigella flexneri. We show that the Shigella T3SS exhibits unique features distinguishing it from other structurally characterized T3SSs. The secretin pore complex adopts a new fold of its C-terminal S domain and the pilotin MxiM[SctG] locates around the outer surface of the pore. The export apparatus structure exhibits a conserved pseudohelical arrangement but includes the N-terminal domain of the SpaS[SctU] subunit, which was not present in any of the previously published virulence-related T3SS structures. Similar to other T3SSs, however, the apparatus is anchored within the needle complex by a network of flexible linkers that either adjust conformation to connect to equivalent patches on the secretin oligomer or bind distinct surface patches at the same height of the export apparatus. The conserved and unique features delineated by our analysis highlight the necessity to analyze T3SS in a species-specific manner, in order to fully understand the underlying molecular mechanisms of these systems. The structure of the type III secretion system from Shigella flexneri delineates conserved and unique features, which could be used for the development of broad-range therapeutics. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8axl.cif.gz 8axl.cif.gz | 844.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8axl.ent.gz pdb8axl.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  8axl.json.gz 8axl.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ax/8axl https://data.pdbj.org/pub/pdb/validation_reports/ax/8axl ftp://data.pdbj.org/pub/pdb/validation_reports/ax/8axl ftp://data.pdbj.org/pub/pdb/validation_reports/ax/8axl | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  15701MC  8axkC  8axnC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 63230.414 Da / 分子数: 15 / 由来タイプ: 天然 由来: (天然)  Shigella flexneri (フレクスナー赤痢菌) Shigella flexneri (フレクスナー赤痢菌)参照: UniProt: Q04641 |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 |
| |||||||||||||||||||||
| 由来(天然) |
| |||||||||||||||||||||
| 緩衝液 | pH: 8 | |||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | |||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのタイプ: Quantifoil R2/1 | |||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 295 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 101179 X / 最大 デフォーカス(公称値): 4000 nm / 最小 デフォーカス(公称値): 1500 nm / Cs: 2.7 mm |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 1.5 sec. / 電子線照射量: 25 e/Å2 / 検出モード: INTEGRATING フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 撮影したグリッド数: 1 / 実像数: 5238 |
| 画像スキャン | 横: 4096 / 縦: 4096 / 動画フレーム数/画像: 7 / 利用したフレーム数/画像: 1-6 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.18.2_3874: / 分類: 精密化 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C15 (15回回転対称) | ||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.42 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 69589 詳細: Focused reconstruction obtained after partial signal subtraction. 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||
| 原子モデル構築 | B value: 72.8 / プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー






 PDBj
PDBj