+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-22698 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | nucleosome and Gal4 complex | |||||||||
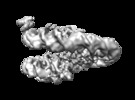
 マップデータ マップデータ | Nucleosome and Gal4 complex | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報CBF3 complex / sexual sporulation resulting in formation of a cellular spore / septin ring assembly / cupric reductase (NADH) activity / HATs acetylate histones / global genome nucleotide-excision repair / RNA polymerase I upstream activating factor complex / Condensation of Prophase Chromosomes / SIRT1 negatively regulates rRNA expression / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 ...CBF3 complex / sexual sporulation resulting in formation of a cellular spore / septin ring assembly / cupric reductase (NADH) activity / HATs acetylate histones / global genome nucleotide-excision repair / RNA polymerase I upstream activating factor complex / Condensation of Prophase Chromosomes / SIRT1 negatively regulates rRNA expression / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / centromeric DNA binding / Assembly of the ORC complex at the origin of replication / HDACs deacetylate histones / kinetochore assembly / Recruitment and ATM-mediated phosphorylation of repair and signaling proteins at DNA double strand breaks / replication fork protection complex / Oxidative Stress Induced Senescence / RMTs methylate histone arginines / postreplication repair / SUMOylation of chromatin organization proteins / DNA binding, bending / mitotic spindle assembly checkpoint signaling / positive regulation of transcription by RNA polymerase I / RNA Polymerase I Promoter Escape / nucleolar large rRNA transcription by RNA polymerase I / Estrogen-dependent gene expression / rRNA transcription / CENP-A containing nucleosome / intracellular copper ion homeostasis / Ub-specific processing proteases / nucleosomal DNA binding / heterochromatin formation / aerobic respiration / kinetochore / structural constituent of chromatin / nucleosome / nucleosome assembly / chromatin organization / DNA-binding transcription factor activity, RNA polymerase II-specific / protein heterodimerization activity / DNA repair / regulation of DNA-templated transcription / negative regulation of transcription by RNA polymerase II / DNA binding / zinc ion binding / identical protein binding / nucleus 類似検索 - 分子機能 | |||||||||
| 生物種 |   | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.2 Å | |||||||||
 データ登録者 データ登録者 | Ruifang G / Yawen B | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Structural and dynamic mechanisms of CBF3-guided centromeric nucleosome formation. 著者: Ruifang Guan / Tengfei Lian / Bing-Rui Zhou / Emily He / Carl Wu / Martin Singleton / Yawen Bai /   要旨: Accurate chromosome segregation relies on the specific centromeric nucleosome-kinetochore interface. In budding yeast, the centromere CBF3 complex guides the deposition of CENP-A, an H3 variant, to ...Accurate chromosome segregation relies on the specific centromeric nucleosome-kinetochore interface. In budding yeast, the centromere CBF3 complex guides the deposition of CENP-A, an H3 variant, to form the centromeric nucleosome in a DNA sequence-dependent manner. Here, we determine the structures of the centromeric nucleosome containing the native CEN3 DNA and the CBF3core bound to the canonical nucleosome containing an engineered CEN3 DNA. The centromeric nucleosome core structure contains 115 base pair DNA including a CCG motif. The CBF3core specifically recognizes the nucleosomal CCG motif through the Gal4 domain while allosterically altering the DNA conformation. Cryo-EM, modeling, and mutational studies reveal that the CBF3core forms dynamic interactions with core histones H2B and CENP-A in the CEN3 nucleosome. Our results provide insights into the structure of the budding yeast centromeric nucleosome and the mechanism of its assembly, which have implications for analogous processes of human centromeric nucleosome formation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_22698.map.gz emd_22698.map.gz | 78.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-22698-v30.xml emd-22698-v30.xml emd-22698.xml emd-22698.xml | 16.3 KB 16.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_22698.png emd_22698.png | 97.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-22698 http://ftp.pdbj.org/pub/emdb/structures/EMD-22698 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22698 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22698 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_22698.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_22698.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Nucleosome and Gal4 complex | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : the nucleosome and Gal4 domain complex
| 全体 | 名称: the nucleosome and Gal4 domain complex |
|---|---|
| 要素 |
|
-超分子 #1: the nucleosome and Gal4 domain complex
| 超分子 | 名称: the nucleosome and Gal4 domain complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#7 |
|---|---|
| 由来(天然) | 生物種:  |
| 組換発現 | 生物種:  Escherichia phage EcSzw-2 (ファージ) Escherichia phage EcSzw-2 (ファージ) |
-分子 #1: Histone H3
| 分子 | 名称: Histone H3 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 15.391007 KDa |
| 組換発現 | 生物種:  Escherichia phage EcSzw-2 (ファージ) Escherichia phage EcSzw-2 (ファージ) |
| 配列 | 文字列: MARTKQTARK STGGKAPRKQ LASKAARKSA PSTGGVKKPH RYKPGTVALR EIRRFQKSTE LLIRKLPFQR LVREIAQDFK TDLRFQSSA IGALQESVEA YLVSLFEDTN LAAIHAKRVT IQKKDIKLAR RLRGERS |
-分子 #2: Histone H4
| 分子 | 名称: Histone H4 / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 11.39539 KDa |
| 組換発現 | 生物種:  Escherichia phage EcSzw-2 (ファージ) Escherichia phage EcSzw-2 (ファージ) |
| 配列 | 文字列: MSGRGKGGKG LGKGGAKRHR KILRDNIQGI TKPAIRRLAR RGGVKRISGL IYEEVRAVLK SFLESVIRDS VTYTEHAKRK TVTSLDVVY ALKRQGRTLY GFGG |
-分子 #3: Histone H2A.1
| 分子 | 名称: Histone H2A.1 / タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 14.013177 KDa |
| 組換発現 | 生物種:  Escherichia phage EcSzw-2 (ファージ) Escherichia phage EcSzw-2 (ファージ) |
| 配列 | 文字列: MSGGKGGKAG SAAKASQSRS AKAGLTFPVG RVHRLLRRGN YAQRIGSGAP VYLTAVLEYL AAEILELAGN AARDNKKTRI IPRHLQLAI RNDDELNKLL GNVTIAQGGV LPNIHQNLLP KKSAKATKAS QEL |
-分子 #4: Histone H2B.1
| 分子 | 名称: Histone H2B.1 / タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 14.280362 KDa |
| 組換発現 | 生物種:  Escherichia phage EcSzw-2 (ファージ) Escherichia phage EcSzw-2 (ファージ) |
| 配列 | 文字列: MSAKAEKKPA SKAPAEKKPA AKKTSTSTDG KKRSKARKET YSSYIYKVLK QTHPDTGISQ KSMSILNSFV NDIFERIATE ASKLAAYNK KSTISAREIQ TAVRLILPGE LAKHAVSEGT RAVTKYSSST QA |
-分子 #7: Centromere DNA-binding protein complex CBF3 subunit B
| 分子 | 名称: Centromere DNA-binding protein complex CBF3 subunit B タイプ: protein_or_peptide / ID: 7 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 5.605748 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MFNRTTQLKS KHPCSVCTRR KVKCDRMIPC GNCRKRGQDS ECMKSTKL |
-分子 #5: DNA (147-MER)
| 分子 | 名称: DNA (147-MER) / タイプ: dna / ID: 5 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 45.334012 KDa |
| 配列 | 文字列: (DA)(DT)(DC)(DG)(DA)(DG)(DA)(DA)(DT)(DC) (DC)(DC)(DG)(DG)(DT)(DG)(DC)(DC)(DG)(DA) (DG)(DG)(DC)(DC)(DG)(DC)(DT)(DC)(DA) (DA)(DT)(DT)(DG)(DG)(DT)(DC)(DG)(DT)(DA) (DG) (DA)(DC)(DA)(DG)(DC) ...文字列: (DA)(DT)(DC)(DG)(DA)(DG)(DA)(DA)(DT)(DC) (DC)(DC)(DG)(DG)(DT)(DG)(DC)(DC)(DG)(DA) (DG)(DG)(DC)(DC)(DG)(DC)(DT)(DC)(DA) (DA)(DT)(DT)(DG)(DG)(DT)(DC)(DG)(DT)(DA) (DG) (DA)(DC)(DA)(DG)(DC)(DT)(DC)(DT) (DA)(DG)(DC)(DA)(DC)(DC)(DG)(DC)(DT)(DT) (DA)(DA) (DA)(DC)(DG)(DC)(DA)(DC)(DG) (DT)(DA)(DC)(DG)(DC)(DG)(DC)(DT)(DG)(DT) (DC)(DC)(DC) (DC)(DC)(DG)(DC)(DG)(DT) (DT)(DT)(DT)(DA)(DA)(DT)(DA)(DT)(DT)(DA) (DG)(DT)(DG)(DT) (DA)(DT)(DT)(DT)(DG) (DA)(DT)(DT)(DT)(DC)(DC)(DG)(DA)(DA)(DA) (DG)(DT)(DT)(DA)(DA) (DA)(DA)(DA)(DA) (DG)(DA)(DA)(DA)(DT)(DA)(DG)(DT)(DA)(DA) (DG)(DA)(DA)(DA)(DT)(DC) (DA)(DT)(DC) (DC)(DG)(DA)(DT) |
-分子 #6: DNA (147-MER)
| 分子 | 名称: DNA (147-MER) / タイプ: dna / ID: 6 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 45.399992 KDa |
| 配列 | 文字列: (DA)(DT)(DC)(DG)(DG)(DA)(DT)(DG)(DA)(DT) (DT)(DT)(DC)(DT)(DT)(DA)(DC)(DT)(DA)(DT) (DT)(DT)(DC)(DT)(DT)(DT)(DT)(DT)(DT) (DA)(DA)(DC)(DT)(DT)(DT)(DC)(DG)(DG)(DA) (DA) (DA)(DT)(DC)(DA)(DA) ...文字列: (DA)(DT)(DC)(DG)(DG)(DA)(DT)(DG)(DA)(DT) (DT)(DT)(DC)(DT)(DT)(DA)(DC)(DT)(DA)(DT) (DT)(DT)(DC)(DT)(DT)(DT)(DT)(DT)(DT) (DA)(DA)(DC)(DT)(DT)(DT)(DC)(DG)(DG)(DA) (DA) (DA)(DT)(DC)(DA)(DA)(DA)(DT)(DA) (DC)(DA)(DC)(DT)(DA)(DA)(DT)(DA)(DT)(DT) (DA)(DA) (DA)(DA)(DC)(DG)(DC)(DG)(DG) (DG)(DG)(DG)(DA)(DC)(DA)(DG)(DC)(DG)(DC) (DG)(DT)(DA) (DC)(DG)(DT)(DG)(DC)(DG) (DT)(DT)(DT)(DA)(DA)(DG)(DC)(DG)(DG)(DT) (DG)(DC)(DT)(DA) (DG)(DA)(DG)(DC)(DT) (DG)(DT)(DC)(DT)(DA)(DC)(DG)(DA)(DC)(DC) (DA)(DA)(DT)(DT)(DG) (DA)(DG)(DC)(DG) (DG)(DC)(DC)(DT)(DC)(DG)(DG)(DC)(DA)(DC) (DC)(DG)(DG)(DG)(DA)(DT) (DT)(DC)(DT) (DC)(DG)(DA)(DT) |
-分子 #8: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 8 / コピー数: 2 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.3 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 71.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 4.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 115666 |
|---|---|
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー