+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-13066 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Metabolon-embedded pyruvate dehydrogenase complex E2 core at near-atomic resolution | |||||||||
 マップデータ マップデータ | Icosahedral symmetrized map for the E2 core of PDHc from C. thermophilum | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | pyruvate / dehydrogenase / complex / e2 / core / c.thermophilum / metabolon / TRANSFERASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報dihydrolipoyllysine-residue acetyltransferase / dihydrolipoyllysine-residue acetyltransferase activity / acetyl-CoA biosynthetic process from pyruvate / : 類似検索 - 分子機能 | |||||||||
| 生物種 |  Chaetomium thermophilum var. thermophilum DSM 1495 (菌類) / Chaetomium thermophilum var. thermophilum DSM 1495 (菌類) /  Chaetomium thermophilum (strain DSM 1495 / CBS 144.50 / IMI 039719) (菌類) Chaetomium thermophilum (strain DSM 1495 / CBS 144.50 / IMI 039719) (菌類) | |||||||||
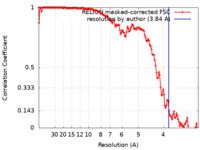
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.84 Å | |||||||||
 データ登録者 データ登録者 | Tueting C / Kyrilis FL / Hamdi F / Kastritis PL | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Cryo-EM snapshots of a native lysate provide structural insights into a metabolon-embedded transacetylase reaction. 著者: Christian Tüting / Fotis L Kyrilis / Johannes Müller / Marija Sorokina / Ioannis Skalidis / Farzad Hamdi / Yashar Sadian / Panagiotis L Kastritis /   要旨: Found across all kingdoms of life, 2-keto acid dehydrogenase complexes possess prominent metabolic roles and form major regulatory sites. Although their component structures are known, their higher- ...Found across all kingdoms of life, 2-keto acid dehydrogenase complexes possess prominent metabolic roles and form major regulatory sites. Although their component structures are known, their higher-order organization is highly heterogeneous, not only across species or tissues but also even within a single cell. Here, we report a cryo-EM structure of the fully active Chaetomium thermophilum pyruvate dehydrogenase complex (PDHc) core scaffold at 3.85 Å resolution (FSC = 0.143) from native cell extracts. By combining cryo-EM with macromolecular docking and molecular dynamics simulations, we resolve all PDHc core scaffold interfaces and dissect the residing transacetylase reaction. Electrostatics attract the lipoyl domain to the transacetylase active site and stabilize the coenzyme A, while apolar interactions position the lipoate in its binding cleft. Our results have direct implications on the structural determinants of the transacetylase reaction and the role of flexible regions in the context of the overall 10 MDa PDHc metabolon architecture. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_13066.map.gz emd_13066.map.gz | 201.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-13066-v30.xml emd-13066-v30.xml emd-13066.xml emd-13066.xml | 23.2 KB 23.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_13066_fsc.xml emd_13066_fsc.xml | 13.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_13066.png emd_13066.png | 200.6 KB | ||
| マスクデータ |  emd_13066_msk_1.map emd_13066_msk_1.map | 216 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-13066.cif.gz emd-13066.cif.gz | 6.2 KB | ||
| その他 |  emd_13066_additional_1.map.gz emd_13066_additional_1.map.gz emd_13066_additional_2.map.gz emd_13066_additional_2.map.gz emd_13066_half_map_1.map.gz emd_13066_half_map_1.map.gz emd_13066_half_map_2.map.gz emd_13066_half_map_2.map.gz | 201 MB 200.7 MB 170.7 MB 170.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-13066 http://ftp.pdbj.org/pub/emdb/structures/EMD-13066 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13066 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13066 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_13066_validation.pdf.gz emd_13066_validation.pdf.gz | 883.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_13066_full_validation.pdf.gz emd_13066_full_validation.pdf.gz | 883.1 KB | 表示 | |
| XML形式データ |  emd_13066_validation.xml.gz emd_13066_validation.xml.gz | 20.8 KB | 表示 | |
| CIF形式データ |  emd_13066_validation.cif.gz emd_13066_validation.cif.gz | 27.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13066 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13066 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13066 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13066 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7ottMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10892 (タイトル: Cryo-EM SPA dataset of Megadalton-range protein communities from a Chaetomium thermophilum native cell extract EMPIAR-10892 (タイトル: Cryo-EM SPA dataset of Megadalton-range protein communities from a Chaetomium thermophilum native cell extractData size: 1.1 TB Data #1: Unaligned fractions saved by Falcon 3 EC camera [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_13066.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_13066.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Icosahedral symmetrized map for the E2 core of PDHc from C. thermophilum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.5678 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_13066_msk_1.map emd_13066_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Asymmetric map for the E2 core of PDHc from C. thermophilum
| ファイル | emd_13066_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Asymmetric map for the E2 core of PDHc from C. thermophilum | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: C2 symmetrized map for the E2 core of PDHc from C. thermophilum
| ファイル | emd_13066_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | C2 symmetrized map for the E2 core of PDHc from C. thermophilum | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Icosahedral symmetrized map for the E2 core of...
| ファイル | emd_13066_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Icosahedral symmetrized map for the E2 core of PDHc from C. thermophilum - Half-map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Icosahedral symmetrized map for the E2 core of...
| ファイル | emd_13066_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Icosahedral symmetrized map for the E2 core of PDHc from C. thermophilum - Half-map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Metabolon-embedded pyruvate dehydrogenase complex E2 core at near...
| 全体 | 名称: Metabolon-embedded pyruvate dehydrogenase complex E2 core at near-atomic resolution |
|---|---|
| 要素 |
|
-超分子 #1: Metabolon-embedded pyruvate dehydrogenase complex E2 core at near...
| 超分子 | 名称: Metabolon-embedded pyruvate dehydrogenase complex E2 core at near-atomic resolution タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Icosahedrally symmetrized E2 core component of the pyruvate dehydrogenase complex metabolon from the thermophilic fungus Chaetomium thermophilum |
|---|---|
| 由来(天然) | 生物種:  Chaetomium thermophilum var. thermophilum DSM 1495 (菌類) Chaetomium thermophilum var. thermophilum DSM 1495 (菌類) |
-分子 #1: Acetyltransferase component of pyruvate dehydrogenase complex
| 分子 | 名称: Acetyltransferase component of pyruvate dehydrogenase complex タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: dihydrolipoyllysine-residue acetyltransferase |
|---|---|
| 由来(天然) | 生物種:  Chaetomium thermophilum (strain DSM 1495 / CBS 144.50 / IMI 039719) (菌類) Chaetomium thermophilum (strain DSM 1495 / CBS 144.50 / IMI 039719) (菌類)株: DSM 1495 / CBS 144.50 / IMI 039719 |
| 分子量 | 理論値: 48.777488 KDa |
| 配列 | 文字列: MLAQVLRRQA LQHVRLARAA APSLTRWYAS YPPHTIVKMP ALSPTMTSGN IGAWQKKPGD AITPGEVLVE IETDKAQMDF EFQEEGVLA KILKETGEKD VAVGSPIAVL VEEGTDINAF QNFTLEDAGG DAAAPAAPAK EELAKAETAP TPASTSAPEP E ETTSTGKL ...文字列: MLAQVLRRQA LQHVRLARAA APSLTRWYAS YPPHTIVKMP ALSPTMTSGN IGAWQKKPGD AITPGEVLVE IETDKAQMDF EFQEEGVLA KILKETGEKD VAVGSPIAVL VEEGTDINAF QNFTLEDAGG DAAAPAAPAK EELAKAETAP TPASTSAPEP E ETTSTGKL EPALDREPNV SFAAKKLAHE LDVPLKALKG TGPGGKITEE DVKKAASAPA AAAAAPGAAY QDIPISNMRK TI ATRLKES VSENPHFFVT SELSVSKLLK LRQALNSSAE GRYKLSVNDF LIKAIAVACK RVPAVNSSWR DGVIRQFDTV DVS VAVATP TGLITPIVKG VEAKGLETIS ATVKELAKKA RDGKLKPEDY QGGTISISNM GMNPAVERFT AIINPPQAAI LAVG TTKKV AVPVENEDGT TGVEWDDQIV VTASFDHKVV DGAVGAEWMR ELKKVVENPL ELLL UniProtKB: Dihydrolipoyllysine-residue acetyltransferase component of pyruvate dehydrogenase complex, mitochondrial |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.3 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 / 構成要素 - 濃度: 200.0 mM / 構成要素 - 式: C2H7NO2 / 構成要素 - 名称: Ammonium ethanoate 詳細: Buffer was freshly made from solid ammonium acetate, filtrated, and degassed by ultrasonication. |
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 200 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 25 sec. / 前処理 - 気圧: 0.04 kPa |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 温度 | 最低: 77.15 K / 最高: 103.15 K |
| アライメント法 | Coma free - Residual tilt: 14.7 mrad |
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: INTEGRATING / デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / 撮影したグリッド数: 1 / 実像数: 2808 / 平均電子線量: 30.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 倍率(補正後): 95677 / 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 92000 |
| 試料ステージ | 試料ホルダーモデル: OTHER / ホルダー冷却材: NITROGEN |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Chain ID: A / Chain - Source name: PDB / Chain - Initial model type: experimental model |
|---|---|
| 詳細 | The initial model was fitted using ChimeraX and then subsequently refined using iterative cycles of manual refinement using Coot and automatic Real-space refinement using PHENIX. |
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
| 得られたモデル |  PDB-7ott: |
 ムービー
ムービー コントローラー
コントローラー
















 Z
Z Y
Y X
X