+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10944 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Head segment of the S.cerevisiae condensin holocomplex in presence of ATP | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Condensin chromosome condensation SMC protein / CELL CYCLE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of meiotic DNA double-strand break formation / Condensation of Prometaphase Chromosomes / tRNA gene clustering / meiotic chromosome condensation / meiotic chromosome separation / condensin complex / DNA secondary structure binding / rDNA chromatin condensation / synaptonemal complex assembly / mitotic chromosome condensation ...negative regulation of meiotic DNA double-strand break formation / Condensation of Prometaphase Chromosomes / tRNA gene clustering / meiotic chromosome condensation / meiotic chromosome separation / condensin complex / DNA secondary structure binding / rDNA chromatin condensation / synaptonemal complex assembly / mitotic chromosome condensation / chromosome condensation / minor groove of adenine-thymine-rich DNA binding / mitotic sister chromatid segregation / condensed chromosome / double-stranded DNA binding / cell division / chromatin binding / chromatin / ATP hydrolysis activity / mitochondrion / ATP binding / nucleus / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |   | |||||||||
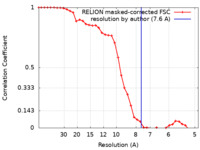
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 7.6 Å | |||||||||
 データ登録者 データ登録者 | Merkel F / Haering CH | |||||||||
| 資金援助 | European Union, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2020 ジャーナル: Nat Struct Mol Biol / 年: 2020タイトル: Cryo-EM structures of holo condensin reveal a subunit flip-flop mechanism. 著者: Byung-Gil Lee / Fabian Merkel / Matteo Allegretti / Markus Hassler / Christopher Cawood / Léa Lecomte / Francis J O'Reilly / Ludwig R Sinn / Pilar Gutierrez-Escribano / Marc Kschonsak / Sol ...著者: Byung-Gil Lee / Fabian Merkel / Matteo Allegretti / Markus Hassler / Christopher Cawood / Léa Lecomte / Francis J O'Reilly / Ludwig R Sinn / Pilar Gutierrez-Escribano / Marc Kschonsak / Sol Bravo / Takanori Nakane / Juri Rappsilber / Luis Aragon / Martin Beck / Jan Löwe / Christian H Haering /    要旨: Complexes containing a pair of structural maintenance of chromosomes (SMC) family proteins are fundamental for the three-dimensional (3D) organization of genomes in all domains of life. The ...Complexes containing a pair of structural maintenance of chromosomes (SMC) family proteins are fundamental for the three-dimensional (3D) organization of genomes in all domains of life. The eukaryotic SMC complexes cohesin and condensin are thought to fold interphase and mitotic chromosomes, respectively, into large loop domains, although the underlying molecular mechanisms have remained unknown. We used cryo-EM to investigate the nucleotide-driven reaction cycle of condensin from the budding yeast Saccharomyces cerevisiae. Our structures of the five-subunit condensin holo complex at different functional stages suggest that ATP binding induces the transition of the SMC coiled coils from a folded-rod conformation into a more open architecture. ATP binding simultaneously triggers the exchange of the two HEAT-repeat subunits bound to the SMC ATPase head domains. We propose that these steps result in the interconversion of DNA-binding sites in the catalytic core of condensin, forming the basis of the DNA translocation and loop-extrusion activities. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10944.map.gz emd_10944.map.gz | 576.5 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10944-v30.xml emd-10944-v30.xml emd-10944.xml emd-10944.xml | 22 KB 22 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_10944_fsc.xml emd_10944_fsc.xml | 3.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_10944.png emd_10944.png | 80.2 KB | ||
| マスクデータ |  emd_10944_msk_1.map emd_10944_msk_1.map | 3.8 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-10944.cif.gz emd-10944.cif.gz | 8.5 KB | ||
| その他 |  emd_10944_half_map_1.map.gz emd_10944_half_map_1.map.gz emd_10944_half_map_2.map.gz emd_10944_half_map_2.map.gz | 2.8 MB 2.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10944 http://ftp.pdbj.org/pub/emdb/structures/EMD-10944 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10944 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10944 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10944_validation.pdf.gz emd_10944_validation.pdf.gz | 648.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10944_full_validation.pdf.gz emd_10944_full_validation.pdf.gz | 647.7 KB | 表示 | |
| XML形式データ |  emd_10944_validation.xml.gz emd_10944_validation.xml.gz | 8.9 KB | 表示 | |
| CIF形式データ |  emd_10944_validation.cif.gz emd_10944_validation.cif.gz | 11.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10944 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10944 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10944 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10944 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10944.map.gz / 形式: CCP4 / 大きさ: 3.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10944.map.gz / 形式: CCP4 / 大きさ: 3.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.448 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_10944_msk_1.map emd_10944_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_10944_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_10944_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : condensin
| 全体 | 名称: condensin |
|---|---|
| 要素 |
|
-超分子 #1: condensin
| 超分子 | 名称: condensin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all / 詳細: Engaged form in present of nucleotide |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 650 KDa |
-分子 #1: Condensin complex subunit 2
| 分子 | 名称: Condensin complex subunit 2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 92.730164 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTTQLRYENN DDDERVEYNL FTNRSTMMAN FEEWIKMATD NKINSRNSWN FALIDYFYDL DVLKDGENNI NFQKASATLD GCIKIYSSR VDSVTTETGK LLSGLAQRKT NGASNGDDSN GGNGEGLGGD SDEANIEIDP LTGMPISNDP DVNNTRRRVY N RVLETTLV ...文字列: MTTQLRYENN DDDERVEYNL FTNRSTMMAN FEEWIKMATD NKINSRNSWN FALIDYFYDL DVLKDGENNI NFQKASATLD GCIKIYSSR VDSVTTETGK LLSGLAQRKT NGASNGDDSN GGNGEGLGGD SDEANIEIDP LTGMPISNDP DVNNTRRRVY N RVLETTLV EFETIKMKEL DQELIIDPLF KKALVDFDEG GAKSLLLNTL NIDNTARVIF DASIKDTQNV GQGKLQRKEE EL IERDSLV DDENEPSQSL ISTRNDSTVN DSVISAPSME DEILSLGMDF IKFDQIAVCE ISGSIEQLRN VVEDINQAKD FIE NVNNRF DNFLTEEELQ AAVPDNAEDD SDGFDMGMQQ ELCYPDENHD NTSHDEQDDD NVNSTTGSIF EKDLMAYFDE NLNR NWRGR EHWKVRNFKK ANLVNKESDL LEETRTTIGD TTDKNTTDDK SMDTKKKHKQ KKVLEIDFFK TDDSFEDKVF ASKGR TKID MPIKNRKNDT HYLLPDDFHF STDRITRLFI KPGQKMSLFS HRKHTRGDVS SGLFEKSTVS ANHSNNDIPT IADEHF WAD NYERKEQEEK EKEQSKEVGD VVGGALDNPF EDDMDGVDFN QAFEGTDDNE EASVKLDLQD DEDHKFPIRE NKVTYSR VS KKVDVRRLKK NVWRSINNLI QEHDSRKNRE QSSNDSETHT EDESTKELKF SDIIQGISKM YSDDTLKDIS TSFCFICL L HLANEHGLQI THTENYNDLI VNYEDLATTQ AASLVGGGHH HHHHGGHHHH HHGGRIFYPY DVPDYAGYPY DVPDYAGSY PYDVPDYAAG H UniProtKB: Condensin complex subunit 2 |
-分子 #2: Condensin complex subunit 3
| 分子 | 名称: Condensin complex subunit 3 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 117.981 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MQDPDGIDIN TKIFNSVAEV FQKAQGSYAG HRKHIAVLKK IQSKAVEQGY EDAFNFWFDK LVTKILPLKK NEIIGDRIVK LVAAFIASL ERELILAKKQ NYKLTNDEEG IFSRFVDQFI RHVLRGVESP DKNVRFRVLQ LLAVIMDNIG EIDESLFNLL I LSLNKRIY ...文字列: MQDPDGIDIN TKIFNSVAEV FQKAQGSYAG HRKHIAVLKK IQSKAVEQGY EDAFNFWFDK LVTKILPLKK NEIIGDRIVK LVAAFIASL ERELILAKKQ NYKLTNDEEG IFSRFVDQFI RHVLRGVESP DKNVRFRVLQ LLAVIMDNIG EIDESLFNLL I LSLNKRIY DREPTVRIQA VFCLTKFQDE EQTEHLTELS DNEENFEATR TLVASIQNDP SAEVRRAAML NLINDNNTRP YI LERARDV NIVNRRLVYS RILKSMGRKC FDDIEPHIFD QLIEWGLEDR ELSVRNACKR LIAHDWLNAL DGDLIELLEK LDV SRSSVC VKAIEALFQS RPDILSKIKF PESIWKDFTV EIAFLFRAIY LYCLDNNITE MLEENFPEAS KLSEHLNHYI LLRY HHNDI SNDSQSHFDY NTLEFIIEQL SIAAERYDYS DEVGRRSMLT VVRNMLALTT LSEPLIKIGI RVMKSLSINE KDFVT MAIE IINDIRDDDI EKQEQEEKIK SKKINRRNET SVDEEDENGT HNDEVNEDEE DDNISSFHSA VENLVQGNGN VSESDI INN LPPEKEASSA TIVLCLTRSS YMLELVNTPL TENILIASLM DTLITPAVRN TAPNIRELGV KNLGLCCLLD VKLAIDN MY ILGMCVSKGN ASLKYIALQV IVDIFSVHGN TVVDGEGKVD SISLHKIFYK VLKNNGLPEC QVIAAEGLCK LFLADVFT D DDLFETLVLS YFSPINSSNE ALVQAFAFCI PVYCFSHPAH QQRMSRTAAD ILLRLCVLWD DLQSSVIPEV DREAMLKPN IIFQQLLFWT DPRNLVNQTG STKKDTVQLT FLIDVLKIYA QIEKKEIKKM IITNINAIFL SSEQDYSTLK ELLEYSDDIA ENDNLDNVS KNALDKLRNN LNSLIEEINE RSETQTKDEN NTANDQYSSI LGNSFNKSSN DTIEHAADIT DGNNTELTKT T VNISAVDN TTEQSNSRKR TRSEAEQIDT SKNLENMSIQ DTSTVAKNVS FVLPDEKSDA MSIDEEDKDS ESFSEVC UniProtKB: Condensin complex subunit 3 |
-分子 #3: Structural maintenance of chromosomes protein 2
| 分子 | 名称: Structural maintenance of chromosomes protein 2 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 134.125875 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MKVEELIIDG FKSYATRTVI TDWDPQFNAI TGLNGSGKSN ILDAICFVLG IASMSTVRAS SLQDLIYKRG QAGVTKASVT IVFDNTDKS NSPIGFTNSP QISVTRQVVL GGTSKYLING HRAPQQSVLQ LFQSVQLNIN NPNFLIMQGK ITKVLNMKPS E ILSLIEEA ...文字列: MKVEELIIDG FKSYATRTVI TDWDPQFNAI TGLNGSGKSN ILDAICFVLG IASMSTVRAS SLQDLIYKRG QAGVTKASVT IVFDNTDKS NSPIGFTNSP QISVTRQVVL GGTSKYLING HRAPQQSVLQ LFQSVQLNIN NPNFLIMQGK ITKVLNMKPS E ILSLIEEA AGTKMFEDRR EKAERTMSKK ETKLQENRTL LTEEIEPKLE KLRNEKRMFL EFQSTQTDLE KTERIVVSYE YY NIKHKHT SIRETLENGE TRMKMLNEFV KKTSEEIDSL NEDVEEIKLQ KEKELHKEGT ISKLENKENG LLNEISRLKT SLS IKVENL NDTTEKSKAL ESEIASSSAK LIEKKSAYAN TEKDYKMVQE QLSKQRDLYK RKEELVSTLT TGISSTGAAD GGYN AQLAK AKTELNEVSL AIKKSSMKME LLKKELLTIE PKLKEATKDN ELNVKHVKQC QETCDKLRAR LVEYGFDPSR IKDLK QRED KLKSHYYQTC KNSEYLKRRV TNLEFNYTKP YPNFEASFVH GVVGQLFQID NDNIRYATAL QTCAGGRLFN VVVQDS QTA TQLLERGRLR KRVTIIPLDK IYTRPISSQV LDLAKKIAPG KVELAINLIR FDESITKAME FIFGNSLICE DPETAKK IT FHPKIRARSI TLQGDVYDPE GTLSGGSRNT SESLLVDIQK YNQIQKQIET IQADLNHVTE ELQTQYATSQ KTKTIQSD L NLSLHKLDLA KRNLDANPSS QIIARNEEIL RDIGECENEI KTKQMSLKKC QEEVSTIEKD MKEYDSDKGS KLNELKKEL KLLAKELEEQ ESESERKYDL FQNLELETEQ LSSELDSNKT LLHNHLKSIE SLKLENSDLE GKIRGVEDDL VTVQTELNEE KKRLMDIDD ELNELETLIK KKQDEKKSSE LELQKLVHDL NKYKSNTNNM EKIIEDLRQK HEFLEDFDLV RNIVKQNEGI D LDTYRERS KQLNEKFQEL RKKVNPNIMN MIENVEKKEA ALKTMIKTIE KDKMKIQETI SKLNEYKRET LVKTWEKVTL DF GNIFADL LPNSFAKLVP CEGKDVTQGL EVKVKLGNIW KESLIELSGG QRSLIALSLI MALLQFRPAP MYILDEVDAA LDL SHTQNI GHLIKTRFKG SQFIVVSLKE GMFANANRVF RTRFQDGTSV VSIM UniProtKB: Structural maintenance of chromosomes protein 2 |
-分子 #4: Structural maintenance of chromosomes protein 4
| 分子 | 名称: Structural maintenance of chromosomes protein 4 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 168.192625 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSDSPLSKRQ KRKAAQEPEL SLDQGDAEEE SQVENRVNLS ENTPEPDLPA LEASYSKSYT PRKLVLSSGE NRYAFSQPTN STTTSLHVP NLQPPKTSSR GRDHKSYSQS PPRSPGRSPT RRLELLQLSP VKNSRVELQK IYDSHQSSSK QQSRLFINEL V LENFKSYA ...文字列: MSDSPLSKRQ KRKAAQEPEL SLDQGDAEEE SQVENRVNLS ENTPEPDLPA LEASYSKSYT PRKLVLSSGE NRYAFSQPTN STTTSLHVP NLQPPKTSSR GRDHKSYSQS PPRSPGRSPT RRLELLQLSP VKNSRVELQK IYDSHQSSSK QQSRLFINEL V LENFKSYA GKQVVGPFHT SFSAVVGPNG SGKSNVIDSM LFVFGFRANK MRQDRLSDLI HKSEAFPSLQ SCSVAVHFQY VI DESSGTS RIDEEKPGLI ITRKAFKNNS SKYYINEKES SYTEVTKLLK NEGIDLDHKR FLILQGEVEN IAQMKPKAEK ESD DGLLEY LEDIIGTANY KPLIEERMGQ IENLNEVCLE KENRFEIVDR EKNSLESGKE TALEFLEKEK QLTLLRSKLF QFKL LQSNS KLASTLEKIS SSNKDLEDER MKFQESLKKV DEIKAQRKEI KDRISSCSSK EKTLVLERRE LEGTRVSLEE RTKNL VSKM EKAEKTLKST KHSISEAENM LEELRGQQTE HETEIKDLTQ LLEKERSILD DIKLSLKDKT KDISAEIIRH EKELEP WDL QLQEKESQIQ LAESELSLLE ETQAKLKKNV ETLEEKILAK KTHKQELQDL ILDLKKKLNS LKDERSQGEK NFTSAHL KL KEMQKVLNAH RQRAMEARSS LSKAQNKSKV LTALSRLQKS GRINGFHGRL GDLGAIDDSF DIAISTACPR LDDVVVDT V ECAQHCIDYL RKNKLGYARF ILLDRLRQFN LQPISTPENV PRLFDLVKPK NPKFSNAFYS VLRDTLVAQN LKQANNVAY GKKRFRVVTV DGKLIDISGT MSGGGNHVAK GLMKLGTNQS DKVDDYTPEE VDKIERELSE RENNFRVASD TVHEMEEELK KLRDHEPDL ESQISKAEME ADSLASELTL AEQQVKEAEM AYVKAVSDKA QLNVVMKNLE RLRGEYNDLQ SETKTKKEKI K GLQDEIMK IGGIKLQMQN SKVESVCQKL DILVAKLKKV KSASKKSGGD VVKFQKLLQN SERDVELSSN ELKVIEEQLK HT KLALAEN DTNMTETLNL KVELKEQSEQ LKEQMEDMEE SINEFKSIEI EMKNKLEKLN SLLTYIKSEI TQQEKGLNEL SIR DVTHTL GMLDDNKMDS VKEDVKNNQE LDQEYRSCET QDESEIKDDE TSCDNYHPMN VDETSDEVSR GIPRLSEDEL RELD VELIE SKINELSYYV EETNVDIGVL EEYARRLAEF KRRKLDLNNA VQKRDEVKEQ LGILKKKRFD EFMAGFNIIS MTLKE MYQM ITMGGNAELE LVDSLDPFSE GVTFSVMPPK KSWRNITNLS GGEKTLSSLA LVFALHKYKP TPLYVMDEID AALDFR NVS IVANYIKERT KNAQFIVISL RNNMFELAQQ LVGVYKRDNR TKSTTIKNID ILNRTRIPGL INGATGWSHP QFEKAGG GS GGGSGGGSWS HPQFEKGGGS GGGSGGGSWS HPQFEK UniProtKB: Structural maintenance of chromosomes protein 4 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 200 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 45.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)