+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of human apo ALDH1A1 determined by cryoEM at 100 keV | |||||||||||||||||||||
 マップデータ マップデータ | ||||||||||||||||||||||
 試料 試料 |
| |||||||||||||||||||||
 キーワード キーワード | Oxidoreductase Aldehyde dehydrogenase / OXIDOREDUCTASE | |||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報fructosamine catabolic process / 3-deoxyglucosone dehydrogenase activity / benzaldehyde dehydrogenase (NAD+) / benzaldehyde dehydrogenase (NAD+) activity / maintenance of lens transparency / retinal dehydrogenase / gamma-aminobutyric acid biosynthetic process / aminobutyraldehyde dehydrogenase / aminobutyraldehyde dehydrogenase (NAD+) activity / Fructose catabolism ...fructosamine catabolic process / 3-deoxyglucosone dehydrogenase activity / benzaldehyde dehydrogenase (NAD+) / benzaldehyde dehydrogenase (NAD+) activity / maintenance of lens transparency / retinal dehydrogenase / gamma-aminobutyric acid biosynthetic process / aminobutyraldehyde dehydrogenase / aminobutyraldehyde dehydrogenase (NAD+) activity / Fructose catabolism / aldehyde metabolic process / Ethanol oxidation / RA biosynthesis pathway / glyceraldehyde-3-phosphate dehydrogenase (NAD+) (non-phosphorylating) activity / aldehyde dehydrogenase (NAD+) / cellular detoxification of aldehyde / androgen binding / aldehyde dehydrogenase (NAD+) activity / retinal dehydrogenase activity / retinol metabolic process / negative regulation of cold-induced thermogenesis / retinoid metabolic process / GTPase activator activity / NAD binding / axon / synapse / extracellular exosome / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||
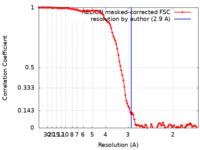
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.9 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | McMullan G / Naydenova K / Mihaylov D / Peet MJ / Wilson H / Yamashita K / Dickerson JL / Chen S / Cannone G / Lee Y ...McMullan G / Naydenova K / Mihaylov D / Peet MJ / Wilson H / Yamashita K / Dickerson JL / Chen S / Cannone G / Lee Y / Hutchings KA / Gittins O / Sobhy M / Wells T / El-Gomati MM / Dalby J / Meffert M / Schulze-Briese C / Henderson R / Russo CJ | |||||||||||||||||||||
| 資金援助 |  英国, 6件 英国, 6件
| |||||||||||||||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2023 ジャーナル: Proc Natl Acad Sci U S A / 年: 2023タイトル: Structure determination by cryoEM at 100 keV. 著者: Greg McMullan / Katerina Naydenova / Daniel Mihaylov / Keitaro Yamashita / Mathew J Peet / Hugh Wilson / Joshua L Dickerson / Shaoxia Chen / Giuseppe Cannone / Yang Lee / Katherine A ...著者: Greg McMullan / Katerina Naydenova / Daniel Mihaylov / Keitaro Yamashita / Mathew J Peet / Hugh Wilson / Joshua L Dickerson / Shaoxia Chen / Giuseppe Cannone / Yang Lee / Katherine A Hutchings / Olivia Gittins / Mohamed A Sobhy / Torquil Wells / Mohamed M El-Gomati / Jason Dalby / Matthias Meffert / Clemens Schulze-Briese / Richard Henderson / Christopher J Russo /    要旨: Electron cryomicroscopy can, in principle, determine the structures of most biological molecules but is currently limited by access, specimen preparation difficulties, and cost. We describe a purpose- ...Electron cryomicroscopy can, in principle, determine the structures of most biological molecules but is currently limited by access, specimen preparation difficulties, and cost. We describe a purpose-built instrument operating at 100 keV-including advances in electron optics, detection, and processing-that makes structure determination fast and simple at a fraction of current costs. The instrument attains its theoretical performance limits, allowing atomic resolution imaging of gold test specimens and biological molecular structure determination in hours. We demonstrate its capabilities by determining the structures of eleven different specimens, ranging in size from 140 kDa to 2 MDa, using a fraction of the data normally required. CryoEM with a microscope designed specifically for high-efficiency, on-the-spot imaging of biological molecules will expand structural biology to a wide range of previously intractable problems. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_17966.map.gz emd_17966.map.gz | 20.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-17966-v30.xml emd-17966-v30.xml emd-17966.xml emd-17966.xml | 18 KB 18 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_17966_fsc.xml emd_17966_fsc.xml | 11.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_17966.png emd_17966.png | 100.7 KB | ||
| マスクデータ |  emd_17966_msk_1.map emd_17966_msk_1.map | 125 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-17966.cif.gz emd-17966.cif.gz | 6.3 KB | ||
| その他 |  emd_17966_half_map_1.map.gz emd_17966_half_map_1.map.gz emd_17966_half_map_2.map.gz emd_17966_half_map_2.map.gz | 97.2 MB 96.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-17966 http://ftp.pdbj.org/pub/emdb/structures/EMD-17966 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17966 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17966 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_17966_validation.pdf.gz emd_17966_validation.pdf.gz | 745.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_17966_full_validation.pdf.gz emd_17966_full_validation.pdf.gz | 745.4 KB | 表示 | |
| XML形式データ |  emd_17966_validation.xml.gz emd_17966_validation.xml.gz | 18.8 KB | 表示 | |
| CIF形式データ |  emd_17966_validation.cif.gz emd_17966_validation.cif.gz | 24.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17966 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17966 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17966 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17966 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8pvhMC  8pv9C  8pvaC  8pvbC  8pvcC  8pvdC  8pveC  8pvfC  8pvgC  8pviC  8pvjC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_17966.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_17966.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.8415 Å | ||||||||||||||||||||||||||||||||||||
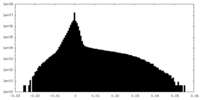
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_17966_msk_1.map emd_17966_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
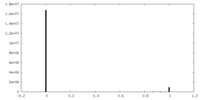
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_17966_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
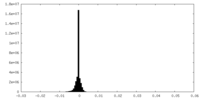
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_17966_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
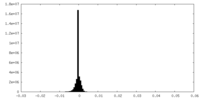
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human apo ALDH1A1
| 全体 | 名称: Human apo ALDH1A1 |
|---|---|
| 要素 |
|
-超分子 #1: Human apo ALDH1A1
| 超分子 | 名称: Human apo ALDH1A1 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Aldehyde dehydrogenase 1A1
| 分子 | 名称: Aldehyde dehydrogenase 1A1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: aminobutyraldehyde dehydrogenase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 57.99298 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSYYHHHHHH LESTSLYKKA GSAAAPFTSS SGTPDLPVLL TDLKIQYTKI FINNEWHDSV SGKKFPVFNP ATEEELCQVE EGDKEDVDK AVKAARQAFQ IGSPWRTMDA SERGRLLYKL ADLIERDRLL LATMESMNGG KLYSNAYLND LAGCIKTLRY C AGWADKIQ ...文字列: MSYYHHHHHH LESTSLYKKA GSAAAPFTSS SGTPDLPVLL TDLKIQYTKI FINNEWHDSV SGKKFPVFNP ATEEELCQVE EGDKEDVDK AVKAARQAFQ IGSPWRTMDA SERGRLLYKL ADLIERDRLL LATMESMNGG KLYSNAYLND LAGCIKTLRY C AGWADKIQ GRTIPIDGNF FTYTRHEPIG VCGQIIPWNF PLVMLIWKIG PALSCGNTVV VKPAEQTPLT ALHVASLIKE AG FPPGVVN IVPGYGPTAG AAISSHMDID KVAFTGSTEV GKLIKEAAGK SNLKRVTLEL GGKSPCIVLA DADLDNAVEF AHH GVFYHQ GQCCIAASRI FVEESIYDEF VRRSVERAKK YILGNPLTPG VTQGPQIDKE QYDKILDLIE SGKKEGAKLE CGGG PWGNK GYFVQPTVFS NVTDEMRIAK EEIFGPVQQI MKFKSLDDVI KRANNTFYGL SAGVFTKDID KAITISSALQ AGTVW VNCY GVVSAQCPFG GFKMSGNGRE LGEYGFHEYT EVKTVTVKIS QKNS UniProtKB: Aldehyde dehydrogenase 1A1 |
-分子 #2: CHLORIDE ION
| 分子 | 名称: CHLORIDE ION / タイプ: ligand / ID: 2 / コピー数: 1 / 式: CL |
|---|---|
| 分子量 | 理論値: 35.453 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| グリッド | モデル: UltrAuFoil R0./1 / 材質: GOLD |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 1400/HR + YPS FEG |
|---|---|
| 撮影 | フィルム・検出器のモデル: DECTRIS SINGLA (1k x 1k) 平均電子線量: 41.0 e/Å2 |
| 電子線 | 加速電圧: 100 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 試料ステージ | 試料ホルダーモデル: GATAN 626 SINGLE TILT LIQUID NITROGEN CRYO TRANSFER HOLDER ホルダー冷却材: NITROGEN |
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)