+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7d6v | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Mycobacterium smegmatis Sdh1 in complex with UQ1 | ||||||||||||
 要素 要素 |
| ||||||||||||
 キーワード キーワード | OXIDOREDUCTASE / succinate dehydrogenase / electron transport chain / Mycobacterium smegmatis / Sdh1 / SQR | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報酸化還元酵素; CH-CH結合に対し酸化酵素として働く / membrane => GO:0016020 / tricarboxylic acid cycle / 2 iron, 2 sulfur cluster binding / 4 iron, 4 sulfur cluster binding / electron transfer activity / oxidoreductase activity / metal ion binding 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Mycolicibacterium smegmatis (バクテリア) Mycolicibacterium smegmatis (バクテリア) | ||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.53 Å | ||||||||||||
 データ登録者 データ登録者 | Zhou, X. / Gao, Y. / Wang, Q. / Gong, H. / Rao, Z. | ||||||||||||
| 資金援助 |  中国, 3件 中国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2021 ジャーナル: Proc Natl Acad Sci U S A / 年: 2021タイトル: Architecture of the mycobacterial succinate dehydrogenase with a membrane-embedded Rieske FeS cluster. 著者: Xiaoting Zhou / Yan Gao / Weiwei Wang / Xiaolin Yang / Xiuna Yang / Fengjiang Liu / Yanting Tang / Sin Man Lam / Guanghou Shui / Lu Yu / Changlin Tian / Luke W Guddat / Quan Wang / Zihe Rao / Hongri Gong /   要旨: Complex II, also known as succinate dehydrogenase (SQR) or fumarate reductase (QFR), is an enzyme involved in both the Krebs cycle and oxidative phosphorylation. Mycobacterial Sdh1 has recently been ...Complex II, also known as succinate dehydrogenase (SQR) or fumarate reductase (QFR), is an enzyme involved in both the Krebs cycle and oxidative phosphorylation. Mycobacterial Sdh1 has recently been identified as a new class of respiratory complex II (type F) but with an unknown electron transfer mechanism. Here, using cryoelectron microscopy, we have determined the structure of Sdh1 in the presence and absence of the substrate, ubiquinone-1, at 2.53-Å and 2.88-Å resolution, respectively. Sdh1 comprises three subunits, two that are water soluble, SdhA and SdhB, and one that is membrane spanning, SdhC. Within these subunits we identified a quinone-binding site and a rarely observed Rieske-type [2Fe-2S] cluster, the latter being embedded in the transmembrane region. A mutant, where two His ligands of the Rieske-type [2Fe-2S] were changed to alanine, abolished the quinone reduction activity of the Sdh1. Our structures allow the proposal of an electron transfer pathway that connects the substrate-binding and quinone-binding sites. Given the unique features of Sdh1 and its essential role in , these structures will facilitate antituberculosis drug discovery efforts that specifically target this complex. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7d6v.cif.gz 7d6v.cif.gz | 209.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7d6v.ent.gz pdb7d6v.ent.gz | 162.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7d6v.json.gz 7d6v.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7d6v_validation.pdf.gz 7d6v_validation.pdf.gz | 1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7d6v_full_validation.pdf.gz 7d6v_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  7d6v_validation.xml.gz 7d6v_validation.xml.gz | 37.1 KB | 表示 | |
| CIF形式データ |  7d6v_validation.cif.gz 7d6v_validation.cif.gz | 56 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/d6/7d6v https://data.pdbj.org/pub/pdb/validation_reports/d6/7d6v ftp://data.pdbj.org/pub/pdb/validation_reports/d6/7d6v ftp://data.pdbj.org/pub/pdb/validation_reports/d6/7d6v | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Succinate dehydrogenase ... , 2種, 2分子 AC
| #1: タンパク質 | 分子量: 70147.180 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis (バクテリア) Mycolicibacterium smegmatis (バクテリア)参照: UniProt: A0A0D6G5S3, 酸化還元酵素; CH-CH結合に対し酸化酵素として働く |
|---|---|
| #3: タンパク質 | 分子量: 32583.545 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis (バクテリア) Mycolicibacterium smegmatis (バクテリア)参照: UniProt: A0A0D6G6P6 |
-タンパク質 , 1種, 1分子 B
| #2: タンパク質 | 分子量: 28851.988 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  Mycolicibacterium smegmatis (バクテリア) Mycolicibacterium smegmatis (バクテリア)参照: UniProt: A0A0D6G6K3 |
|---|
-非ポリマー , 6種, 7分子 



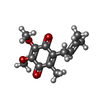






| #4: 化合物 | ChemComp-FAD / | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| #5: 化合物 | | #6: 化合物 | ChemComp-SF4 / | #7: 化合物 | ChemComp-F3S / | #8: 化合物 | ChemComp-UQ1 / | #9: 化合物 | ChemComp-PEV / ( | |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Mycobacterium smegmatis Sdh1 in complex with UQ1 / タイプ: COMPLEX / 詳細: succinate dehydrogenase / Entity ID: #1-#3 / 由来: NATURAL |
|---|---|
| 由来(天然) | 生物種:  Mycolicibacterium smegmatis MC2 51 (バクテリア) Mycolicibacterium smegmatis MC2 51 (バクテリア) |
| 緩衝液 | pH: 7.5 |
| 試料 | 濃度: 5 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 装置: FEI VITROBOT MARK II / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 281 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD |
| 撮影 | 電子線照射量: 60 e/Å2 / 検出モード: SUPER-RESOLUTION フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.18.2_3874: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.53 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 252092 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj


















