+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-30552 | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
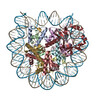
| タイトル | Cryo-EM structure of SET8-CENP-A-nucleosome complex | |||||||||||||||||||||
 マップデータ マップデータ | SET8-CENP-A-nucleosome complex | |||||||||||||||||||||
 試料 試料 |
| |||||||||||||||||||||
 キーワード キーワード | chromatin / nucleosome / NUCLEAR PROTEIN | |||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報lysine N-methyltransferase activity / histone H4K20 monomethyltransferase activity / [histone H4]-lysine20 N-methyltransferase / histone H4K20 methyltransferase activity / histone H4 methyltransferase activity / peptidyl-lysine monomethylation / polytene chromosome / CENP-A containing chromatin assembly / kinetochore assembly / protein localization to chromosome, centromeric region ...lysine N-methyltransferase activity / histone H4K20 monomethyltransferase activity / [histone H4]-lysine20 N-methyltransferase / histone H4K20 methyltransferase activity / histone H4 methyltransferase activity / peptidyl-lysine monomethylation / polytene chromosome / CENP-A containing chromatin assembly / kinetochore assembly / protein localization to chromosome, centromeric region / condensed chromosome, centromeric region / mitotic chromosome condensation / protein-lysine N-methyltransferase activity / regulation of DNA damage response, signal transduction by p53 class mediator / histone methyltransferase activity / establishment of mitotic spindle orientation / mitotic cytokinesis / chromosome, centromeric region / negative regulation of tumor necrosis factor-mediated signaling pathway / negative regulation of double-strand break repair via homologous recombination / pericentric heterochromatin / negative regulation of megakaryocyte differentiation / protein localization to CENP-A containing chromatin / Replacement of protamines by nucleosomes in the male pronucleus / CENP-A containing nucleosome / Packaging Of Telomere Ends / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / Recognition and association of DNA glycosylase with site containing an affected purine / Cleavage of the damaged purine / Deposition of new CENPA-containing nucleosomes at the centromere / Mitotic Prometaphase / telomere organization / Recognition and association of DNA glycosylase with site containing an affected pyrimidine / Cleavage of the damaged pyrimidine / EML4 and NUDC in mitotic spindle formation / RNA Polymerase I Promoter Opening / Inhibition of DNA recombination at telomere / Assembly of the ORC complex at the origin of replication / Meiotic synapsis / 転移酵素; 一炭素原子の基を移すもの; メチル基を移すもの / SUMOylation of chromatin organization proteins / Regulation of endogenous retroelements by the Human Silencing Hub (HUSH) complex / Resolution of Sister Chromatid Cohesion / DNA methylation / regulation of signal transduction by p53 class mediator / Condensation of Prophase Chromosomes / Chromatin modifications during the maternal to zygotic transition (MZT) / SIRT1 negatively regulates rRNA expression / HCMV Late Events / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / PRC2 methylates histones and DNA / innate immune response in mucosa / Regulation of endogenous retroelements by KRAB-ZFP proteins / Defective pyroptosis / HDACs deacetylate histones / Regulation of endogenous retroelements by Piwi-interacting RNAs (piRNAs) / RNA Polymerase I Promoter Escape / Nonhomologous End-Joining (NHEJ) / lipopolysaccharide binding / Transcriptional regulation by small RNAs / RHO GTPases Activate Formins / Formation of the beta-catenin:TCF transactivating complex / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / HDMs demethylate histones / G2/M DNA damage checkpoint / NoRC negatively regulates rRNA expression / Regulation of TP53 Activity through Methylation / B-WICH complex positively regulates rRNA expression / PKMTs methylate histone lysines / DNA Damage/Telomere Stress Induced Senescence / Pre-NOTCH Transcription and Translation / Meiotic recombination / Activation of anterior HOX genes in hindbrain development during early embryogenesis / Metalloprotease DUBs / RMTs methylate histone arginines / Transcriptional regulation of granulopoiesis / HCMV Early Events / antimicrobial humoral immune response mediated by antimicrobial peptide / structural constituent of chromatin / Separation of Sister Chromatids / UCH proteinases / transcription corepressor activity / antibacterial humoral response / heterochromatin formation / nucleosome / nucleosome assembly / E3 ubiquitin ligases ubiquitinate target proteins / Recruitment and ATM-mediated phosphorylation of repair and signaling proteins at DNA double strand breaks / HATs acetylate histones / RUNX1 regulates transcription of genes involved in differentiation of HSCs / MLL4 and MLL3 complexes regulate expression of PPARG target genes in adipogenesis and hepatic steatosis / chromatin organization / Processing of DNA double-strand break ends / Senescence-Associated Secretory Phenotype (SASP) / Oxidative Stress Induced Senescence / defense response to Gram-negative bacterium / Estrogen-dependent gene expression / killing of cells of another organism / chromosome, telomeric region 類似検索 - 分子機能 | |||||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) / synthetic construct (人工物) Homo sapiens (ヒト) / synthetic construct (人工物) | |||||||||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.0 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | Ho C-H / Takizawa Y | |||||||||||||||||||||
| 資金援助 |  日本, 6件 日本, 6件
| |||||||||||||||||||||
 引用 引用 |  ジャーナル: Life Sci Alliance / 年: 2021 ジャーナル: Life Sci Alliance / 年: 2021タイトル: Structural basis of nucleosomal histone H4 lysine 20 methylation by SET8 methyltransferase. 著者: Cheng-Han Ho / Yoshimasa Takizawa / Wataru Kobayashi / Yasuhiro Arimura / Hiroshi Kimura / Hitoshi Kurumizaka /  要旨: SET8 is solely responsible for histone H4 lysine-20 (H4K20) monomethylation, which preferentially occurs in nucleosomal H4. However, the underlying mechanism by which SET8 specifically promotes the ...SET8 is solely responsible for histone H4 lysine-20 (H4K20) monomethylation, which preferentially occurs in nucleosomal H4. However, the underlying mechanism by which SET8 specifically promotes the H4K20 monomethylation in the nucleosome has not been elucidated. Here, we report the cryo-EM structures of the human SET8-nucleosome complexes with histone H3 and the centromeric H3 variant, CENP-A. Surprisingly, we found that the overall cryo-EM structures of the SET8-nucleosome complexes are substantially different from the previous crystal structure models. In the complexes with H3 and CENP-A nucleosomes, SET8 specifically binds the nucleosomal acidic patch via an arginine anchor, composed of the Arg188 and Arg192 residues. Mutational analyses revealed that the interaction between the SET8 arginine anchor and the nucleosomal acidic patch plays an essential role in the H4K20 monomethylation activity. These results provide the groundwork for understanding the mechanism by which SET8 specifically accomplishes the H4K20 monomethylation in the nucleosome. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_30552.map.gz emd_30552.map.gz | 2.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-30552-v30.xml emd-30552-v30.xml emd-30552.xml emd-30552.xml | 18.5 KB 18.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_30552_fsc.xml emd_30552_fsc.xml | 6.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_30552.png emd_30552.png | 273.4 KB | ||
| Filedesc metadata |  emd-30552.cif.gz emd-30552.cif.gz | 6.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-30552 http://ftp.pdbj.org/pub/emdb/structures/EMD-30552 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30552 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30552 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_30552_validation.pdf.gz emd_30552_validation.pdf.gz | 431.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_30552_full_validation.pdf.gz emd_30552_full_validation.pdf.gz | 431.3 KB | 表示 | |
| XML形式データ |  emd_30552_validation.xml.gz emd_30552_validation.xml.gz | 9.5 KB | 表示 | |
| CIF形式データ |  emd_30552_validation.cif.gz emd_30552_validation.cif.gz | 12.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30552 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30552 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30552 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30552 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_30552.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_30552.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | SET8-CENP-A-nucleosome complex | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.05 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : SET8-CENP-A-nucleosome complex
| 全体 | 名称: SET8-CENP-A-nucleosome complex |
|---|---|
| 要素 |
|
-超分子 #1: SET8-CENP-A-nucleosome complex
| 超分子 | 名称: SET8-CENP-A-nucleosome complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#7 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 230 KDa |
-分子 #1: Histone H3-like centromeric protein A
| 分子 | 名称: Histone H3-like centromeric protein A / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 16.305906 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSHMGPRRRS RKPEAPRRRS PSPTPTPGPS RRGPSLGASS HQHSRRRQGW LKEIRKLQKS THLLIRKLPF SRLAREICVK FTRGVDFNW QAQALLALQE AAEAFLVHLF EDAYLLTLHA GRVTLFPKDV QLARRIRGLE EGLG UniProtKB: Histone H3-like centromeric protein A |
-分子 #2: Histone H4
| 分子 | 名称: Histone H4 / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 11.676703 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSHMSGRGKG GKGLGKGGAK RHRKVLRDNI QGITKPAIRR LARRGGVKRI SGLIYEETRG VLKVFLENVI RDAVTYTEHA KRKTVTAMD VVYALKRQGR TLYGFGG UniProtKB: Histone H4 |
-分子 #3: Histone H2A type 1-B/E
| 分子 | 名称: Histone H2A type 1-B/E / タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 14.447825 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSHMSGRGKQ GGKARAKAKT RSSRAGLQFP VGRVHRLLRK GNYSERVGAG APVYLAAVLE YLTAEILELA GNAARDNKKT RIIPRHLQL AIRNDEELNK LLGRVTIAQG GVLPNIQAVL LPKKTESHHK AKGK UniProtKB: Histone H2A type 1-B/E |
-分子 #4: Histone H2B type 1-J
| 分子 | 名称: Histone H2B type 1-J / タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 14.217516 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSHMPEPAKS APAPKKGSKK AVTKAQKKDG KKRKRSRKES YSIYVYKVLK QVHPDTGISS KAMGIMNSFV NDIFERIAGE ASRLAHYNK RSTITSREIQ TAVRLLLPGE LAKHAVSEGT KAVTKYTSAK UniProtKB: Histone H2B type 1-J |
-分子 #7: Isoform 2 of N-lysine methyltransferase KMT5A
| 分子 | 名称: Isoform 2 of N-lysine methyltransferase KMT5A / タイプ: protein_or_peptide / ID: 7 / コピー数: 1 / 光学異性体: LEVO EC番号: 転移酵素; 一炭素原子の基を移すもの; メチル基を移すもの |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 39.295793 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MARGRKMSKP RAVEAAAAAA AVAATAPGPE MVERRGPGRP RTDGENVFTG QSKIYSYMSP NKCSGMRFPL QEENSVTHHE VKCQGKPLA GIYRKREEKR NAGNAVRSAM KSEEQKIKDA RKGPLVPFPN QKSEAAEPPK TPPSSCDSTN AAIAKQALKK P IKGKQAPR ...文字列: MARGRKMSKP RAVEAAAAAA AVAATAPGPE MVERRGPGRP RTDGENVFTG QSKIYSYMSP NKCSGMRFPL QEENSVTHHE VKCQGKPLA GIYRKREEKR NAGNAVRSAM KSEEQKIKDA RKGPLVPFPN QKSEAAEPPK TPPSSCDSTN AAIAKQALKK P IKGKQAPR KKAQGKTQQN RKLTDFYPVR RSSRKSKAEL QSEERKRIDE LIESGKEEGM KIDLIDGKGR GVIATKQFSR GD FVVEYHG DLIEITDAKK REALYAQDPS TGCYMYYFQY LSKTYCVDAT RETNRLGRLI NHSKCGNCQT KLHDIDGVPH LIL IASRDI AAGEELLYDY GDRSKASIEA HPWLKH UniProtKB: N-lysine methyltransferase KMT5A |
-分子 #5: DNA (145-MER)
| 分子 | 名称: DNA (145-MER) / タイプ: dna / ID: 5 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 44.520383 KDa |
| 配列 | 文字列: (DA)(DT)(DC)(DA)(DG)(DA)(DA)(DT)(DC)(DC) (DC)(DG)(DG)(DT)(DG)(DC)(DC)(DG)(DA)(DG) (DG)(DC)(DC)(DG)(DC)(DT)(DC)(DA)(DA) (DT)(DT)(DG)(DG)(DT)(DC)(DG)(DT)(DA)(DG) (DA) (DC)(DA)(DG)(DC)(DT) ...文字列: (DA)(DT)(DC)(DA)(DG)(DA)(DA)(DT)(DC)(DC) (DC)(DG)(DG)(DT)(DG)(DC)(DC)(DG)(DA)(DG) (DG)(DC)(DC)(DG)(DC)(DT)(DC)(DA)(DA) (DT)(DT)(DG)(DG)(DT)(DC)(DG)(DT)(DA)(DG) (DA) (DC)(DA)(DG)(DC)(DT)(DC)(DT)(DA) (DG)(DC)(DA)(DC)(DC)(DG)(DC)(DT)(DT)(DA) (DA)(DA) (DC)(DG)(DC)(DA)(DC)(DG)(DT) (DA)(DC)(DG)(DC)(DG)(DC)(DT)(DG)(DT)(DC) (DC)(DC)(DC) (DC)(DG)(DC)(DG)(DT)(DT) (DT)(DT)(DA)(DA)(DC)(DC)(DG)(DC)(DC)(DA) (DA)(DG)(DG)(DG) (DG)(DA)(DT)(DT)(DA) (DC)(DT)(DC)(DC)(DC)(DT)(DA)(DG)(DT)(DC) (DT)(DC)(DC)(DA)(DG) (DG)(DC)(DA)(DC) (DG)(DT)(DG)(DT)(DC)(DA)(DG)(DA)(DT)(DA) (DT)(DA)(DT)(DA)(DC)(DA) (DT)(DC)(DG) (DA)(DT) |
-分子 #6: DNA (145-MER)
| 分子 | 名称: DNA (145-MER) / タイプ: dna / ID: 6 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 44.99166 KDa |
| 配列 | 文字列: (DA)(DT)(DC)(DG)(DA)(DT)(DG)(DT)(DA)(DT) (DA)(DT)(DA)(DT)(DC)(DT)(DG)(DA)(DC)(DA) (DC)(DG)(DT)(DG)(DC)(DC)(DT)(DG)(DG) (DA)(DG)(DA)(DC)(DT)(DA)(DG)(DG)(DG)(DA) (DG) (DT)(DA)(DA)(DT)(DC) ...文字列: (DA)(DT)(DC)(DG)(DA)(DT)(DG)(DT)(DA)(DT) (DA)(DT)(DA)(DT)(DC)(DT)(DG)(DA)(DC)(DA) (DC)(DG)(DT)(DG)(DC)(DC)(DT)(DG)(DG) (DA)(DG)(DA)(DC)(DT)(DA)(DG)(DG)(DG)(DA) (DG) (DT)(DA)(DA)(DT)(DC)(DC)(DC)(DC) (DT)(DT)(DG)(DG)(DC)(DG)(DG)(DT)(DT)(DA) (DA)(DA) (DA)(DC)(DG)(DC)(DG)(DG)(DG) (DG)(DG)(DA)(DC)(DA)(DG)(DC)(DG)(DC)(DG) (DT)(DA)(DC) (DG)(DT)(DG)(DC)(DG)(DT) (DT)(DT)(DA)(DA)(DG)(DC)(DG)(DG)(DT)(DG) (DC)(DT)(DA)(DG) (DA)(DG)(DC)(DT)(DG) (DT)(DC)(DT)(DA)(DC)(DG)(DA)(DC)(DC)(DA) (DA)(DT)(DT)(DG)(DA) (DG)(DC)(DG)(DG) (DC)(DC)(DT)(DC)(DG)(DG)(DC)(DA)(DC)(DC) (DG)(DG)(DG)(DA)(DT)(DT) (DC)(DT)(DG) (DA)(DT) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 実像数: 6075 / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
|---|---|
| 得られたモデル |  PDB-7d20: |
 ムービー
ムービー コントローラー
コントローラー


























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)























