+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-2609 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | KIF14 Motor Domain Microtubule complex | |||||||||
 マップデータ マップデータ | kinesin KIF14 mtor domain micerotubule complex | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Kinesin / Micotubule / Tubulin / KIF14 / Kinesin-3 | |||||||||
| 生物種 |   | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 15.5 Å | |||||||||
 データ登録者 データ登録者 | Arora K / Talje L / Asenjo AB / Andersen P / Atchia K / Joshi M / Sosa H / Allingham JS / Kwok BH | |||||||||
 引用 引用 |  ジャーナル: J Mol Biol / 年: 2014 ジャーナル: J Mol Biol / 年: 2014タイトル: KIF14 binds tightly to microtubules and adopts a rigor-like conformation. 著者: Kritica Arora / Lama Talje / Ana B Asenjo / Parker Andersen / Kaleem Atchia / Monika Joshi / Hernando Sosa / John S Allingham / Benjamin H Kwok /   要旨: The mitotic kinesin motor protein KIF14 is essential for cytokinesis during cell division and has been implicated in cerebral development and a variety of human cancers. Here we show that the mouse ...The mitotic kinesin motor protein KIF14 is essential for cytokinesis during cell division and has been implicated in cerebral development and a variety of human cancers. Here we show that the mouse KIF14 motor domain binds tightly to microtubules and does not display typical nucleotide-dependent changes in this affinity. It also has robust ATPase activity but very slow motility. A crystal structure of the ADP-bound form of the KIF14 motor domain reveals a dramatically opened ATP-binding pocket, as if ready to exchange its bound ADP for Mg·ATP. In this state, the central β-sheet is twisted ~10° beyond the maximal amount observed in other kinesins. This configuration has only been seen in the nucleotide-free states of myosins-known as the "rigor-like" state. Fitting of this atomic model to electron density maps from cryo-electron microscopy indicates a distinct binding configuration of the motor domain to microtubules. We postulate that these properties of KIF14 are well suited for stabilizing midbody microtubules during cytokinesis. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_2609.map.gz emd_2609.map.gz | 877.9 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-2609-v30.xml emd-2609-v30.xml emd-2609.xml emd-2609.xml | 9.8 KB 9.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd-2609-Kif14_mapview.JPG emd-2609-Kif14_mapview.JPG | 189.9 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2609 http://ftp.pdbj.org/pub/emdb/structures/EMD-2609 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2609 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2609 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_2609_validation.pdf.gz emd_2609_validation.pdf.gz | 203.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_2609_full_validation.pdf.gz emd_2609_full_validation.pdf.gz | 202.5 KB | 表示 | |
| XML形式データ |  emd_2609_validation.xml.gz emd_2609_validation.xml.gz | 3.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2609 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2609 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2609 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2609 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_2609.map.gz / 形式: CCP4 / 大きさ: 918.9 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_2609.map.gz / 形式: CCP4 / 大きさ: 918.9 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | kinesin KIF14 mtor domain micerotubule complex | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
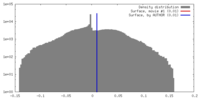
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Kinesin KIF14 motor domain microtubule complex
| 全体 | 名称: Kinesin KIF14 motor domain microtubule complex |
|---|---|
| 要素 |
|
-超分子 #1000: Kinesin KIF14 motor domain microtubule complex
| 超分子 | 名称: Kinesin KIF14 motor domain microtubule complex / タイプ: sample / ID: 1000 / Number unique components: 2 |
|---|
-分子 #1: Kinesin KIF14 motor domain
| 分子 | 名称: Kinesin KIF14 motor domain / タイプ: protein_or_peptide / ID: 1 / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
| 組換発現 | 生物種:  |
-分子 #2: Tubulin
| 分子 | 名称: Tubulin / タイプ: protein_or_peptide / ID: 2 / 組換発現: No / データベース: NCBI |
|---|---|
| 由来(天然) | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / 装置: FEI VITROBOT MARK I |
|---|
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI 20 |
|---|---|
| 日付 | 2013年11月25日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: TVIPS TEMCAM-F415 (4k x 4k) 実像数: 30 |
| 電子線 | 加速電圧: 120 kV / 電子線源: LAB6 |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.6 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | 試料ホルダーモデル: GATAN LIQUID NITROGEN |
- 画像解析
画像解析
| 詳細 | Initial reference map obtained by Fourier-Bessel reconstruction as implemented in SUPRIM & PHOELIX Single particle alignment, 3D reconstruction and refinement done using IHRSR, SPIDER and custom routines. |
|---|---|
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 5.40237 Å 想定した対称性 - らせんパラメータ - ΔΦ: 168.08788 ° 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) 解像度のタイプ: BY AUTHOR / 解像度: 15.5 Å / 解像度の算出法: OTHER ソフトウェア - 名称: SUPRIM, PHOELIX, IHRSR, SPIDER, CTFFIND3, CUSTOM, (emglue.py) |
| CTF補正 | 詳細: Each Particle |
-原子モデル構築 1
| 初期モデル | PDB ID: |
|---|---|
| ソフトウェア | 名称:  Chimera Chimera |
| 詳細 | The 2 domains (tubulin heterodimer and KIF14 motor domain) were separately fitted. 1 nm resolution density maps of the atomic models were fitted within the cryo-em map using the global fit option of the fitmap command of the UCSF-CHIMERA program. |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
-原子モデル構築 2
| 初期モデル | PDB ID: |
|---|---|
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)