+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-22307 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The negative stain EM structure of the human DNA LigIIIalpha-XRCC1 complex; conformer 2 | |||||||||||||||
 マップデータ マップデータ | Refined 3D map of full-length DNA LigaseIII alpha in complex with full-length XRCC1; conformer 2 | |||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | DNA repair / protein-protein interactions / DNA BINDING PROTEIN | |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 31.5 Å | |||||||||||||||
 データ登録者 データ登録者 | Sverzhinsky A / Pascal JM | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Nucleic Acids Res / 年: 2021 ジャーナル: Nucleic Acids Res / 年: 2021タイトル: An atypical BRCT-BRCT interaction with the XRCC1 scaffold protein compacts human DNA Ligase IIIα within a flexible DNA repair complex. 著者: Michal Hammel / Ishtiaque Rashid / Aleksandr Sverzhinsky / Yasin Pourfarjam / Miaw-Sheue Tsai / Tom Ellenberger / John M Pascal / In-Kwon Kim / John A Tainer / Alan E Tomkinson /   要旨: The XRCC1-DNA ligase IIIα complex (XL) is critical for DNA single-strand break repair, a key target for PARP inhibitors in cancer cells deficient in homologous recombination. Here, we combined ...The XRCC1-DNA ligase IIIα complex (XL) is critical for DNA single-strand break repair, a key target for PARP inhibitors in cancer cells deficient in homologous recombination. Here, we combined biophysical approaches to gain insights into the shape and conformational flexibility of the XL as well as XRCC1 and DNA ligase IIIα (LigIIIα) alone. Structurally-guided mutational analyses based on the crystal structure of the human BRCT-BRCT heterodimer identified the network of salt bridges that together with the N-terminal extension of the XRCC1 C-terminal BRCT domain constitute the XL molecular interface. Coupling size exclusion chromatography with small angle X-ray scattering and multiangle light scattering (SEC-SAXS-MALS), we determined that the XL is more compact than either XRCC1 or LigIIIα, both of which form transient homodimers and are highly disordered. The reduced disorder and flexibility allowed us to build models of XL particles visualized by negative stain electron microscopy that predict close spatial organization between the LigIIIα catalytic core and both BRCT domains of XRCC1. Together our results identify an atypical BRCT-BRCT interaction as the stable nucleating core of the XL that links the flexible nick sensing and catalytic domains of LigIIIα to other protein partners of the flexible XRCC1 scaffold. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_22307.map.gz emd_22307.map.gz | 1.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-22307-v30.xml emd-22307-v30.xml emd-22307.xml emd-22307.xml | 14.9 KB 14.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_22307.png emd_22307.png | 33 KB | ||
| Filedesc metadata |  emd-22307.cif.gz emd-22307.cif.gz | 5.8 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-22307 http://ftp.pdbj.org/pub/emdb/structures/EMD-22307 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22307 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22307 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_22307_validation.pdf.gz emd_22307_validation.pdf.gz | 389.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_22307_full_validation.pdf.gz emd_22307_full_validation.pdf.gz | 389.5 KB | 表示 | |
| XML形式データ |  emd_22307_validation.xml.gz emd_22307_validation.xml.gz | 4.9 KB | 表示 | |
| CIF形式データ |  emd_22307_validation.cif.gz emd_22307_validation.cif.gz | 5.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22307 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22307 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22307 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22307 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_22307.map.gz / 形式: CCP4 / 大きさ: 2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_22307.map.gz / 形式: CCP4 / 大きさ: 2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Refined 3D map of full-length DNA LigaseIII alpha in complex with full-length XRCC1; conformer 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 3.3 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
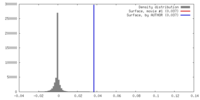
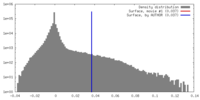
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Full-length DNA LigIII alpha in complex with full-length XRCC1; c...
| 全体 | 名称: Full-length DNA LigIII alpha in complex with full-length XRCC1; conformer 2 |
|---|---|
| 要素 |
|
-超分子 #1: Full-length DNA LigIII alpha in complex with full-length XRCC1; c...
| 超分子 | 名称: Full-length DNA LigIII alpha in complex with full-length XRCC1; conformer 2 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 180 KDa |
-分子 #1: Nuclear DNA ligase III-alpha
| 分子 | 名称: Nuclear DNA ligase III-alpha / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO / EC番号: DNA ligase (ATP) |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAEQRFCVDY AKRGTAGCKK CKEKIVKGVC RIGKVVPNPF SESGGDMKEW YHIKCMFEKL ERARATTKK IEDLTELEGW EELEDNEKEQ ITQHIADLSS KAAGTPKKKA VVQAKLTTTG Q VTSPVKGA SFVTSTNPRK FSGFSAKPNN SGEAPSSPTP KRSLSSSKCD ...文字列: MAEQRFCVDY AKRGTAGCKK CKEKIVKGVC RIGKVVPNPF SESGGDMKEW YHIKCMFEKL ERARATTKK IEDLTELEGW EELEDNEKEQ ITQHIADLSS KAAGTPKKKA VVQAKLTTTG Q VTSPVKGA SFVTSTNPRK FSGFSAKPNN SGEAPSSPTP KRSLSSSKCD PRHKDCLLRE FR KLCAMVA DNPSYNTKTQ IIQDFLRKGS AGDGFHGDVY LTVKLLLPGV IKTVYNLNDK QIV KLFSRI FNCNPDDMAR DLEQGDVSET IRVFFEQSKS FPPAAKSLLT IQEVDEFLLR LSKL TKEDE QQQALQDIAS RCTANDLKCI IRLIKHDLKM NSGAKHVLDA LDPNAYEAFK ASRNL QDVV ERVLHNAQEV EKEPGQRRAL SVQASLMTPV QPMLAEACKS VEYAMKKCPN GMFSEI KYD GERVQVHKNG DHFSYFSRSL KPVLPHKVAH FKDYIPQAFP GGHSMILDSE VLLIDNK TG KPLPFGTLGV HKKAAFQDAN VCLFVFDCIY FNDVSLMDRP LCERRKFLHD NMVEIPNR I MFSEMKRVTK ALDLADMITR VIQEGLEGLV LKDVKGTYEP GKRHWLKVKK DYLNEGAMA DTADLVVLGA FYGQGSKGGM MSIFLMGCYD PGSQKWCTVT KCAGGHDDAT LARLQNELDM VKISKDPSK IPSWLKVNKI YYPDFIVPDP KKAAVWEITG AEFSKSEAHT ADGISIRFPR C TRIRDDKD WKSATNLPQL KELYQLSKEK ADFTVVAGDE GSSTTGGSSE ENKGPSGSAV SR KAPSKPS ASTKKAEGKL SNSNSKDGNM QTAKPSAMKV GEKLATKSSP VKVGEKRKAA DET LCQTKV LLDIFTGVRL YLPPSTPDFS RLRRYFVAFD GDLVQEFDMT SATHVLGSRD KNPA AQQVS PEWIWACIRK RRLVAPCWSH PQFEK |
-分子 #2: DNA repair protein XRCC1
| 分子 | 名称: DNA repair protein XRCC1 / タイプ: protein_or_peptide / ID: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: HHHHHHMPEI RLRHVVSCSS QDSTHCAENL LKADTYRKWR AAKAGEKTIS VVLQLEKEEQ IHSVDI GND GSAFVEVLVG SSAGGAGEQD YEVLLVTSSF MSPSESRSGS NPNRVRMFGP DKLVRAA AE KRWDRVKIVC SQPYSKDSPF GLSFVRFHSP PDKDEAEAPS ...文字列: HHHHHHMPEI RLRHVVSCSS QDSTHCAENL LKADTYRKWR AAKAGEKTIS VVLQLEKEEQ IHSVDI GND GSAFVEVLVG SSAGGAGEQD YEVLLVTSSF MSPSESRSGS NPNRVRMFGP DKLVRAA AE KRWDRVKIVC SQPYSKDSPF GLSFVRFHSP PDKDEAEAPS QKVTVTKLGQ FRVKEEDE S ANSLRPGALF FSRINKTSPV TASDPAGPSY AAATLQASSA ASSASPVSRA IGSTSKPQE SPKGKRKLDL NQEEKKTPSK PPAQLSPSVP KRPKLPAPTR TPATAPVPAR AQGAVTGKPR GEGTEPRRP RAGPEELGKI LQGVVVVLSG FQNPFRSELR DKALELGAKY RPDWTRDSTH L ICAFANTP KYSQVLGLGG RIVRKEWVLD CHRMRRRLPS RRYLMAGPGS SSEEDEASHS GG SGDEAPK LPQKQPQTKT KPTQAAGPSS PQKPPTPEET KAASPVLQED IDIEGVQSEG QDN GAEDSG DTEDELRRVA EQKEHRLPPG QEENGEDPYA GSTDENTDSE EHQEPPDLPV PELP DFFQG KHFFLYGEFP GDERRKLIRY VTAFNGELED NMSDRVQFVI TAQEWDPSFE EALMD NPSL AFVRPRWIYS CNEKQKLLPH QLYGVVPQA |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.01 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| 染色 | タイプ: NEGATIVE / 材質: Uranyl Formate |
| グリッド | 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: AIR |
| 詳細 | Co-purified proteins were crosslinked with glutaraldehyde, then buffer exchanged to remove the crosslinker before negative staining. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI 12 |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI EAGLE (4k x 4k) / 平均露光時間: 1.0 sec. / 平均電子線量: 70.0 e/Å2 |
| 電子線 | 加速電圧: 120 kV / 電子線源: LAB6 |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 倍率(公称値): 67000 |
 ムービー
ムービー コントローラー
コントローラー



 UCSF Chimera
UCSF Chimera








 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)