+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1p0z | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Sensor Kinase CitA binding domain | ||||||
 要素 要素 | Sensor kinase citA | ||||||
 キーワード キーワード | TRANSFERASE / Kinase | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | ||||||
| 生物種 |  Klebsiella pneumoniae (肺炎桿菌) Klebsiella pneumoniae (肺炎桿菌) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  単波長異常分散 / 解像度: 1.6 Å 単波長異常分散 / 解像度: 1.6 Å | ||||||
 データ登録者 データ登録者 | Reinelt, S. / Hofmann, E. / Gerharz, T. / Bott, M. / Madden, D.R. | ||||||
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2003 ジャーナル: J.Biol.Chem. / 年: 2003タイトル: The structure of the periplasmic ligand-binding domain of the sensor kinase CitA reveals the first extracellular PAS domain. 著者: Reinelt, S. / Hofmann, E. / Gerharz, T. / Bott, M. / Madden, D.R. | ||||||
| 履歴 |
| ||||||
| Remark 300 | BIOMOLECULE: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 THIS ENTRY CONTAINS THE CRYSTALLOGRAPHIC ASYMMETRIC UNIT ...BIOMOLECULE: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 THIS ENTRY CONTAINS THE CRYSTALLOGRAPHIC ASYMMETRIC UNIT WHICH CONSISTS OF 10CHAIN(S). SEE REMARK 350 FOR INFORMATION ON GENERATING THE BIOLOGICAL MOLECULE(S). THE MONOMER IS LIGAND-BINDING COMPETENT. GEL FILTRATION ANALYSIS REVEALS WEAK DIMERIZATION IN SOLUTION WHICH MAY REPRESENT THE OLIGOMERIZATION STATE OF THE RECEPTOR IN VIVO. TWO CANDIDATE DIMER INTERFACES ARE DETECTED IN THE CRYSTAL, INVOLVING EITHER CHAINS E AND G OR CHAINS G AND J. | ||||||
| Remark 650 | HELIX determination method: Author determined | ||||||
| Remark 700 | SHEET determination method: Author determined |
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1p0z.cif.gz 1p0z.cif.gz | 317.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1p0z.ent.gz pdb1p0z.ent.gz | 258.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1p0z.json.gz 1p0z.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1p0z_validation.pdf.gz 1p0z_validation.pdf.gz | 5.6 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1p0z_full_validation.pdf.gz 1p0z_full_validation.pdf.gz | 5.7 MB | 表示 | |
| XML形式データ |  1p0z_validation.xml.gz 1p0z_validation.xml.gz | 76 KB | 表示 | |
| CIF形式データ |  1p0z_validation.cif.gz 1p0z_validation.cif.gz | 103.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/p0/1p0z https://data.pdbj.org/pub/pdb/validation_reports/p0/1p0z ftp://data.pdbj.org/pub/pdb/validation_reports/p0/1p0z ftp://data.pdbj.org/pub/pdb/validation_reports/p0/1p0z | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 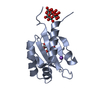
| ||||||||
| 2 | 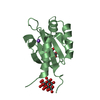
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 5 | 
| ||||||||
| 6 | 
| ||||||||
| 7 | 
| ||||||||
| 8 | 
| ||||||||
| 9 | 
| ||||||||
| 10 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 10分子 ABCDEFGHIJ
| #1: タンパク質 | 分子量: 14315.185 Da / 分子数: 10 / 断片: CitA binding domain / 由来タイプ: 組換発現 / 由来: (組換発現)  Klebsiella pneumoniae (肺炎桿菌) / 遺伝子: CITA / 発現宿主: Klebsiella pneumoniae (肺炎桿菌) / 遺伝子: CITA / 発現宿主:  |
|---|
-非ポリマー , 5種, 1613分子 

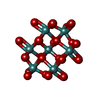






| #2: 化合物 | ChemComp-FLC / #3: 化合物 | ChemComp-NA / #4: 化合物 | ChemComp-MO7 / #5: 化合物 | ChemComp-OMO / #6: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.48 Å3/Da / 溶媒含有率: 50.05 % | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | 温度: 289 K / pH: 6 詳細: HANGING DROP, VAPOUR DIFFUSION, RESERVOIR: 100MM NA2MOO4, 100MM MES, PH 6.0, 8% PEG4000, 2.5% GLYCEROL, PROTEIN SOLUTION: 10MM NACL, 10MM TRIS, PH 8.0, 1MM NA-CITRATE, 16MG/ML PROTEIN CONC. ...詳細: HANGING DROP, VAPOUR DIFFUSION, RESERVOIR: 100MM NA2MOO4, 100MM MES, PH 6.0, 8% PEG4000, 2.5% GLYCEROL, PROTEIN SOLUTION: 10MM NACL, 10MM TRIS, PH 8.0, 1MM NA-CITRATE, 16MG/ML PROTEIN CONC. MIXING RATIO 1:1., temperature 289K | |||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 手法: 蒸気拡散法, ハンギングドロップ法 | |||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: ID14-1 / 波長: 0.9393 / ビームライン: ID14-1 / 波長: 0.9393 |
| 検出器 | タイプ: ADSC QUANTUM 4r / 検出器: CCD / 日付: 2002年5月9日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.9393 Å / 相対比: 1 |
| 反射 | 解像度: 1.6→38.03 Å / Num. obs: 214649 / % possible obs: 95.9 % / 冗長度: 8.7 % / Biso Wilson estimate: 23.6 Å2 / Rsym value: 0.103 / Net I/σ(I): 11.88 |
| 反射 シェル | 解像度: 1.6→1.7 Å / 冗長度: 8.6 % / Mean I/σ(I) obs: 4.24 / Rsym value: 0.646 / % possible all: 92.8 |
| 反射 | *PLUS 最高解像度: 1.6 Å / 最低解像度: 38 Å / % possible obs: 95.8 % / 冗長度: 8.7 % / Rmerge(I) obs: 0.103 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  単波長異常分散 / 解像度: 1.6→38.03 Å / Rfactor Rfree error: 0.002 / Data cutoff high rms absF: 1633341.02 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: MLF 単波長異常分散 / 解像度: 1.6→38.03 Å / Rfactor Rfree error: 0.002 / Data cutoff high rms absF: 1633341.02 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 0 / 立体化学のターゲット値: MLF詳細: The high-res bin for the R_work is different from that for R_free. The bin for R_work is 1.7-1.6 A. The bin for R_free is 1.71 to 1.72. The RMS DEVIATIONS in reamrk 3 are the RMS DEVIATIONS ...詳細: The high-res bin for the R_work is different from that for R_free. The bin for R_work is 1.7-1.6 A. The bin for R_free is 1.71 to 1.72. The RMS DEVIATIONS in reamrk 3 are the RMS DEVIATIONS FOR ALL ATOMS. The RMS DEVIATIONS FROM IDEAL VALUES FOR PROTEIN ATOMS are 0.014A for BOND LENGTHS, 1.70 degree for BOND ANGLES, 23.40 degree for DIHEDRAL ANGLES, 1.07 degree for IMPROPER ANGLES.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: FLAT MODEL / Bsol: 56.47 Å2 / ksol: 0.38 e/Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 28.2 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.6→38.03 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints NCS | NCS model details: RESTRAINED / Weight Biso : 2 / Weight position: 300 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.6→1.7 Å / Total num. of bins used: 6
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS 最高解像度: 1.6 Å / 最低解像度: 38 Å / Rfactor Rfree: 0.19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj











