| 登録情報 | データベース: PDB / ID: 1i7g
|
|---|
| タイトル | CRYSTAL STRUCTURE OF THE LIGAND BINDING DOMAIN FROM HUMAN PPAR-ALPHA IN COMPLEX WITH THE AGONIST AZ 242 |
|---|
 要素 要素 | PEROXISOME PROLIFERATOR ACTIVATED RECEPTOR ALPHA |
|---|
 キーワード キーワード | TRANSCRIPTION / Anti parallel Helix Sandwich |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
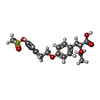
positive regulation of transformation of host cell by virus / regulation of fatty acid transport / enamel mineralization / positive regulation of fatty acid beta-oxidation / cellular response to fructose stimulus / regulation of ketone metabolic process / regulation of fatty acid metabolic process / negative regulation of cell growth involved in cardiac muscle cell development / negative regulation of appetite / negative regulation of hepatocyte apoptotic process ...positive regulation of transformation of host cell by virus / regulation of fatty acid transport / enamel mineralization / positive regulation of fatty acid beta-oxidation / cellular response to fructose stimulus / regulation of ketone metabolic process / regulation of fatty acid metabolic process / negative regulation of cell growth involved in cardiac muscle cell development / negative regulation of appetite / negative regulation of hepatocyte apoptotic process / lipoprotein metabolic process / positive regulation of fatty acid oxidation / behavioral response to nicotine / negative regulation of leukocyte cell-cell adhesion / negative regulation of glycolytic process / ubiquitin conjugating enzyme binding / mitogen-activated protein kinase kinase kinase binding / positive regulation of fatty acid metabolic process / DNA-binding transcription activator activity / NFAT protein binding / negative regulation of cholesterol storage / positive regulation of ATP biosynthetic process / nuclear steroid receptor activity / negative regulation of macrophage derived foam cell differentiation / epidermis development / phosphatase binding / positive regulation of lipid biosynthetic process / Transcriptional regulation of brown and beige adipocyte differentiation by EBF2 / intracellular receptor signaling pathway / negative regulation of blood pressure / nitric oxide metabolic process / hormone-mediated signaling pathway / negative regulation of reactive oxygen species biosynthetic process / : / Regulation of lipid metabolism by PPARalpha / peroxisome proliferator activated receptor signaling pathway / MDM2/MDM4 family protein binding / response to nutrient / positive regulation of gluconeogenesis / negative regulation of cytokine production involved in inflammatory response / negative regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction / BMAL1:CLOCK,NPAS2 activates circadian expression / negative regulation of miRNA transcription / Activation of gene expression by SREBF (SREBP) / cellular response to starvation / gluconeogenesis / SUMOylation of intracellular receptors / circadian regulation of gene expression / fatty acid metabolic process / wound healing / negative regulation of transforming growth factor beta receptor signaling pathway / Heme signaling / Transcriptional activation of mitochondrial biogenesis / PPARA activates gene expression / regulation of circadian rhythm / Cytoprotection by HMOX1 / response to insulin / Transcriptional regulation of white adipocyte differentiation / Nuclear Receptor transcription pathway / negative regulation of inflammatory response / DNA-binding transcription repressor activity, RNA polymerase II-specific / transcription coactivator binding / nuclear receptor activity / : / heart development / DNA-binding transcription activator activity, RNA polymerase II-specific / response to ethanol / gene expression / sequence-specific DNA binding / RNA polymerase II-specific DNA-binding transcription factor binding / cell differentiation / DNA-binding transcription factor activity, RNA polymerase II-specific / response to hypoxia / RNA polymerase II cis-regulatory region sequence-specific DNA binding / DNA-binding transcription factor activity / protein domain specific binding / lipid binding / chromatin / positive regulation of DNA-templated transcription / protein-containing complex binding / negative regulation of transcription by RNA polymerase II / positive regulation of transcription by RNA polymerase II / DNA binding / zinc ion binding / nucleoplasm / nucleus類似検索 - 分子機能 Peroxisome proliferator-activated receptor alpha / Peroxisome proliferator-activated receptor / : / Retinoid X Receptor / Retinoid X Receptor / Nuclear hormone receptor / Nuclear hormones receptors DNA-binding region signature. / Zinc finger, nuclear hormone receptor-type / Double treble clef zinc finger, C4 type / Nuclear hormone receptors DNA-binding domain profile. ...Peroxisome proliferator-activated receptor alpha / Peroxisome proliferator-activated receptor / : / Retinoid X Receptor / Retinoid X Receptor / Nuclear hormone receptor / Nuclear hormones receptors DNA-binding region signature. / Zinc finger, nuclear hormone receptor-type / Double treble clef zinc finger, C4 type / Nuclear hormone receptors DNA-binding domain profile. / c4 zinc finger in nuclear hormone receptors / Nuclear hormone receptor, ligand-binding domain / Nuclear hormone receptor-like domain superfamily / Ligand-binding domain of nuclear hormone receptor / Nuclear receptor (NR) ligand-binding (LBD) domain profile. / Ligand binding domain of hormone receptors / Zinc finger, NHR/GATA-type / Orthogonal Bundle / Mainly Alpha類似検索 - ドメイン・相同性 Chem-AZ2 / Peroxisome proliferator-activated receptor alpha類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.2 Å 分子置換 / 解像度: 2.2 Å |
|---|
 データ登録者 データ登録者 | Petersen, J.F.W. / Cronet, P. / Folmer, R. / Blomberg, N. / Sjoblom, K. / Karlsson, U. / Lindstedt, E.-L. / Bamberg, K. |
|---|
 引用 引用 |  ジャーナル: Structure / 年: 2001 ジャーナル: Structure / 年: 2001
タイトル: Structure of the PPARalpha and -gamma ligand binding domain in complex with AZ 242; ligand selectivity and agonist activation in the PPAR family.
著者: Cronet, P. / Petersen, J.F. / Folmer, R. / Blomberg, N. / Sjoblom, K. / Karlsson, U. / Lindstedt, E.L. / Bamberg, K. |
|---|
| 履歴 | | 登録 | 2001年3月9日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2002年3月9日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年4月27日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2023年8月9日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / pdbx_struct_conn_angle / struct_conn / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr1_symmetry / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.ptnr3_symmetry / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_conn.ptnr2_symmetry / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.2 Å
分子置換 / 解像度: 2.2 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Structure / 年: 2001
ジャーナル: Structure / 年: 2001 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1i7g.cif.gz
1i7g.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1i7g.ent.gz
pdb1i7g.ent.gz PDB形式
PDB形式 1i7g.json.gz
1i7g.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1i7g_validation.pdf.gz
1i7g_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1i7g_full_validation.pdf.gz
1i7g_full_validation.pdf.gz 1i7g_validation.xml.gz
1i7g_validation.xml.gz 1i7g_validation.cif.gz
1i7g_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/i7/1i7g
https://data.pdbj.org/pub/pdb/validation_reports/i7/1i7g ftp://data.pdbj.org/pub/pdb/validation_reports/i7/1i7g
ftp://data.pdbj.org/pub/pdb/validation_reports/i7/1i7g リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 発現宿主:
Homo sapiens (ヒト) / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ESRF
ESRF  / ビームライン: ID14-4 / 波長: 0.9465 Å
/ ビームライン: ID14-4 / 波長: 0.9465 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー
























 PDBj
PDBj