+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Transmembrane domain of resting state homomeric GluA2 F231A mutant AMPA receptor in complex with TARP gamma 2 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | AMPAR / ion channels / neurotransmission / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Presynaptic depolarization and calcium channel opening / eye blink reflex / positive regulation of protein localization to basolateral plasma membrane / cerebellar mossy fiber / neurotransmitter receptor transport, postsynaptic endosome to lysosome / LGI-ADAM interactions / Trafficking of AMPA receptors / regulation of AMPA receptor activity / neurotransmitter receptor internalization / membrane hyperpolarization ...Presynaptic depolarization and calcium channel opening / eye blink reflex / positive regulation of protein localization to basolateral plasma membrane / cerebellar mossy fiber / neurotransmitter receptor transport, postsynaptic endosome to lysosome / LGI-ADAM interactions / Trafficking of AMPA receptors / regulation of AMPA receptor activity / neurotransmitter receptor internalization / membrane hyperpolarization / postsynaptic neurotransmitter receptor diffusion trapping / nervous system process / protein targeting to membrane / voltage-gated calcium channel complex / neurotransmitter receptor localization to postsynaptic specialization membrane / neuromuscular junction development / spine synapse / dendritic spine neck / dendritic spine head / Activation of AMPA receptors / perisynaptic space / AMPA glutamate receptor activity / transmission of nerve impulse / ligand-gated monoatomic cation channel activity / channel regulator activity / Trafficking of GluR2-containing AMPA receptors / response to lithium ion / extracellularly glutamate-gated ion channel activity / immunoglobulin binding / regulation of postsynaptic membrane neurotransmitter receptor levels / AMPA glutamate receptor complex / membrane depolarization / kainate selective glutamate receptor activity / ionotropic glutamate receptor complex / cellular response to glycine / asymmetric synapse / calcium channel regulator activity / regulation of receptor recycling / Unblocking of NMDA receptors, glutamate binding and activation / voltage-gated calcium channel activity / glutamate receptor binding / positive regulation of synaptic transmission / extracellular ligand-gated monoatomic ion channel activity / glutamate-gated receptor activity / response to fungicide / glutamate-gated calcium ion channel activity / presynaptic active zone membrane / regulation of synaptic transmission, glutamatergic / ionotropic glutamate receptor binding / somatodendritic compartment / dendrite membrane / cellular response to brain-derived neurotrophic factor stimulus / ligand-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / cytoskeletal protein binding / dendrite cytoplasm / ionotropic glutamate receptor signaling pathway / hippocampal mossy fiber to CA3 synapse / positive regulation of synaptic transmission, glutamatergic / regulation of membrane potential / SNARE binding / dendritic shaft / synaptic transmission, glutamatergic / synaptic membrane / transmitter-gated monoatomic ion channel activity involved in regulation of postsynaptic membrane potential / PDZ domain binding / protein tetramerization / postsynaptic density membrane / establishment of protein localization / modulation of chemical synaptic transmission / Schaffer collateral - CA1 synapse / terminal bouton / receptor internalization / cerebral cortex development / synaptic vesicle membrane / response to calcium ion / synaptic vesicle / presynapse / signaling receptor activity / presynaptic membrane / amyloid-beta binding / growth cone / scaffold protein binding / chemical synaptic transmission / perikaryon / postsynaptic membrane / dendritic spine / postsynaptic density / neuron projection / axon / neuronal cell body / glutamatergic synapse / dendrite / synapse / protein-containing complex binding / protein kinase binding / cell surface / endoplasmic reticulum / protein-containing complex / identical protein binding / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |   | |||||||||
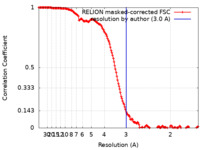
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.0 Å | |||||||||
 データ登録者 データ登録者 | Zhang D / Ivica J / Krieger JM / Ho H / Yamashita K / Cais O / Greger I | |||||||||
| 資金援助 |  英国, 2件 英国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2023 ジャーナル: Nature / 年: 2023タイトル: Structural mobility tunes signalling of the GluA1 AMPA glutamate receptor. 著者: Danyang Zhang / Josip Ivica / James M Krieger / Hinze Ho / Keitaro Yamashita / Imogen Stockwell / Rozbeh Baradaran / Ondrej Cais / Ingo H Greger /   要旨: AMPA glutamate receptors (AMPARs), the primary mediators of excitatory neurotransmission in the brain, are either GluA2 subunit-containing and thus Ca-impermeable, or GluA2-lacking and Ca-permeable. ...AMPA glutamate receptors (AMPARs), the primary mediators of excitatory neurotransmission in the brain, are either GluA2 subunit-containing and thus Ca-impermeable, or GluA2-lacking and Ca-permeable. Despite their prominent expression throughout interneurons and glia, their role in long-term potentiation and their involvement in a range of neuropathologies, structural information for GluA2-lacking receptors is currently absent. Here we determine and characterize cryo-electron microscopy structures of the GluA1 homotetramer, fully occupied with TARPγ3 auxiliary subunits (GluA1/γ3). The gating core of both resting and open-state GluA1/γ3 closely resembles GluA2-containing receptors. However, the sequence-diverse N-terminal domains (NTDs) give rise to a highly mobile assembly, enabling domain swapping and subunit re-alignments in the ligand-binding domain tier that are pronounced in desensitized states. These transitions underlie the unique kinetic properties of GluA1. A GluA2 mutant (F231A) increasing NTD dynamics phenocopies this behaviour, and exhibits reduced synaptic responses, reflecting the anchoring function of the AMPAR NTD at the synapse. Together, this work underscores how the subunit-diverse NTDs determine subunit arrangement, gating properties and ultimately synaptic signalling efficiency among AMPAR subtypes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16382.map.gz emd_16382.map.gz | 12.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16382-v30.xml emd-16382-v30.xml emd-16382.xml emd-16382.xml | 17.7 KB 17.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16382_fsc.xml emd_16382_fsc.xml | 15.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16382.png emd_16382.png | 49.2 KB | ||
| マスクデータ |  emd_16382_msk_1.map emd_16382_msk_1.map | 107.2 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-16382.cif.gz emd-16382.cif.gz | 6.6 KB | ||
| その他 |  emd_16382_half_map_1.map.gz emd_16382_half_map_1.map.gz emd_16382_half_map_2.map.gz emd_16382_half_map_2.map.gz | 99 MB 99 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16382 http://ftp.pdbj.org/pub/emdb/structures/EMD-16382 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16382 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16382 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_16382_validation.pdf.gz emd_16382_validation.pdf.gz | 875.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_16382_full_validation.pdf.gz emd_16382_full_validation.pdf.gz | 875.4 KB | 表示 | |
| XML形式データ |  emd_16382_validation.xml.gz emd_16382_validation.xml.gz | 20.2 KB | 表示 | |
| CIF形式データ |  emd_16382_validation.cif.gz emd_16382_validation.cif.gz | 26.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16382 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16382 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16382 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16382 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8c1sMC  8c1pC  8c1qC  8c1rC  8c2hC  8c2iC  8p3qC  8p3sC  8p3tC  8p3uC  8p3vC  8p3wC  8p3xC  8p3yC  8p3zC  8pivC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16382.map.gz / 形式: CCP4 / 大きさ: 107.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16382.map.gz / 形式: CCP4 / 大きさ: 107.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.826 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_16382_msk_1.map emd_16382_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_16382_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_16382_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : homomeric GluA2 F231A mutant AMPA receptor in complex with TARP g...
| 全体 | 名称: homomeric GluA2 F231A mutant AMPA receptor in complex with TARP gamma 2 |
|---|---|
| 要素 |
|
-超分子 #1: homomeric GluA2 F231A mutant AMPA receptor in complex with TARP g...
| 超分子 | 名称: homomeric GluA2 F231A mutant AMPA receptor in complex with TARP gamma 2 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Glutamate receptor 2
| 分子 | 名称: Glutamate receptor 2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 99.981031 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MQKIMHISVL LSPVLWGLIF GDYKDDDDKV SSNSIQIGGL FPRGADQEYS AFRVGMVQFS TSEFRLTPHI DNLEVANSFA VTNAFCSQF SRGVYAIFGF YDKKSVNTIT SFCGTLHVSF ITPSFPTDGT HPFVIQMRPD LKGALLSLIE YYQWDKFAYL Y DSDRGLST ...文字列: MQKIMHISVL LSPVLWGLIF GDYKDDDDKV SSNSIQIGGL FPRGADQEYS AFRVGMVQFS TSEFRLTPHI DNLEVANSFA VTNAFCSQF SRGVYAIFGF YDKKSVNTIT SFCGTLHVSF ITPSFPTDGT HPFVIQMRPD LKGALLSLIE YYQWDKFAYL Y DSDRGLST LQAVLDSAAE KKWQVTAINV GNINNDKKDE TYRSLFQDLE LKKERRVILD CERDKVNDIV DQVITIGKHV KG YHYIIAN LGFTDGDLLK IQFGGANVSG FQIVDYDDSL VSKFIERWST LEEKEYPGAH TATIKYTSAL TYDAVQVMTE AFR NLRKQR IEISRRGNAG DCLANPAVPW GQGVEIERAL KQVQVEGLSG NIKFDQNGKR INYTINIMEL KTNGPRKIGY WSEV DKMVV TLTELPSGND TSGLENKTVV VTTILESPYV MMKKNHEMLE GNERYEGYCV DLAAEIAKHC GFKYKLTIVG DGKYG ARDA DTKIWNGMVG ELVYGKADIA IAPLTITLVR EEVIDFSKPF MSLGISIMIK KPQKSKPGVF SFLDPLAYEI WMCIVF AYI GVSVVLFLVS RFSPYEWHTE EFEDGRETQS SESTNEFGIF NSLWFSLGAF MRQGCDISPR SLSGRIVGGV WWFFTLI II SSYTANLAAF LTVERMVSPI ESAEDLSKQT EIAYGTLDSG STKEFFRRSK IAVFDKMWTY MRSAEPSVFV RTTAEGVA R VRKSKGKYAY LLESTMNEYI EQRKPCDTMK VGGNLDSKGY GIATPKGSSL RTPVNLAVLK LSEQGVLDKL KNKWWYDKG ECGAKDSGSK EKTSALSLSN VAGVFYILVG GLGLAMLVAL IEFCYKSRAE AKRMKVAKNP QNINPSSSQN SQNFATYKEG YNVYGIESV KI UniProtKB: Glutamate receptor 2 |
-分子 #2: Voltage-dependent calcium channel gamma-2 subunit
| 分子 | 名称: Voltage-dependent calcium channel gamma-2 subunit / タイプ: protein_or_peptide / ID: 2 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 35.807555 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: GLFDRGVQML LTTVGAFAAF SLMTIAVGTD YWLYSRGVCK TKSVSENETS KKNEEVMTHS GLWRTCCLEG NFKGLCKQID HFPEDADYE ADTAEYFLRA VRASSIFPIL SVILLFMGGL CIAASEFYKT RHNIILSAGI FFVSAGLSNI IGIIVYISAN A GDPSKSDS ...文字列: GLFDRGVQML LTTVGAFAAF SLMTIAVGTD YWLYSRGVCK TKSVSENETS KKNEEVMTHS GLWRTCCLEG NFKGLCKQID HFPEDADYE ADTAEYFLRA VRASSIFPIL SVILLFMGGL CIAASEFYKT RHNIILSAGI FFVSAGLSNI IGIIVYISAN A GDPSKSDS KKNSYSYGWS FYFGALSFII AEMVGVLAVH MFIDRHKQLR ATARATDYLQ ASAITRIPSY RYRYQRRSRS SS RSTEPSH SRDASPVGVK GFNTLPSTEI SMYTLSRDPL KAATTPTATY NSDRDNSFLQ VHNCIQKDSK DSLHANTANR RTT PV UniProtKB: Voltage-dependent calcium channel gamma-2 subunit |
-分子 #3: PALMITIC ACID
| 分子 | 名称: PALMITIC ACID / タイプ: ligand / ID: 3 / コピー数: 6 / 式: PLM |
|---|---|
| 分子量 | 理論値: 256.424 Da |
| Chemical component information |  ChemComp-PLM: |
-分子 #4: (2R)-2,3-dihydroxypropyl (9Z)-octadec-9-enoate
| 分子 | 名称: (2R)-2,3-dihydroxypropyl (9Z)-octadec-9-enoate / タイプ: ligand / ID: 4 / コピー数: 4 / 式: OLC |
|---|---|
| 分子量 | 理論値: 356.54 Da |
| Chemical component information |  ChemComp-OLC: |
-分子 #5: (2S)-3-(hexadecanoyloxy)-2-[(9Z)-octadec-9-enoyloxy]propyl 2-(tri...
| 分子 | 名称: (2S)-3-(hexadecanoyloxy)-2-[(9Z)-octadec-9-enoyloxy]propyl 2-(trimethylammonio)ethyl phosphate タイプ: ligand / ID: 5 / コピー数: 4 / 式: POV |
|---|---|
| 分子量 | 理論値: 760.076 Da |
| Chemical component information |  ChemComp-POV: |
-分子 #6: water
| 分子 | 名称: water / タイプ: ligand / ID: 6 / コピー数: 8 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.4 µm 最小 デフォーカス(公称値): 1.4000000000000001 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 詳細 | Servalcat |
|---|---|
| 精密化 | 空間: RECIPROCAL |
| 得られたモデル |  PDB-8c1s: |
 ムービー
ムービー コントローラー
コントローラー

























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)