+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10121 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of LptB2FGC in complex with AMP-PNP | |||||||||
 マップデータ マップデータ | None | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | lipopolysaccharide transporter / LPS / LptB2FGC / LptB / LptBFG / outer membrane / Gram-negative bacteria / ABC transporter / Inner membrane protein complex / TRANSPORT PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報トランスロカーゼ; 炭水化物とその誘導体の輸送を触媒; ヌクレオシド三リン酸の加水分解を伴う / lipopolysaccharide transport / ATP-binding cassette (ABC) transporter complex / transmembrane transport / ATP hydrolysis activity / ATP binding / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Shigella flexneri (フレクスナー赤痢菌) Shigella flexneri (フレクスナー赤痢菌) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.5 Å | |||||||||
 データ登録者 データ登録者 | Tang XD / Chang SH | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2019 ジャーナル: Nat Commun / 年: 2019タイトル: Cryo-EM structures of lipopolysaccharide transporter LptBFGC in lipopolysaccharide or AMP-PNP-bound states reveal its transport mechanism. 著者: Xiaodi Tang / Shenghai Chang / Qinghua Luo / Zhengyu Zhang / Wen Qiao / Caihuang Xu / Changbin Zhang / Yang Niu / Wenxian Yang / Ting Wang / Zhibo Zhang / Xiaofeng Zhu / Xiawei Wei / ...著者: Xiaodi Tang / Shenghai Chang / Qinghua Luo / Zhengyu Zhang / Wen Qiao / Caihuang Xu / Changbin Zhang / Yang Niu / Wenxian Yang / Ting Wang / Zhibo Zhang / Xiaofeng Zhu / Xiawei Wei / Changjiang Dong / Xing Zhang / Haohao Dong /   要旨: Lipopolysaccharides (LPS) of Gram-negative bacteria are critical for the defence against cytotoxic substances and must be transported from the inner membrane (IM) to the outer membrane (OM) through ...Lipopolysaccharides (LPS) of Gram-negative bacteria are critical for the defence against cytotoxic substances and must be transported from the inner membrane (IM) to the outer membrane (OM) through a bridge formed by seven membrane proteins (LptBFGCADE). The IM component LptBFG powers the process through a yet unclarified mechanism. Here we report three high-resolution cryo-EM structures of LptBFG alone and complexed with LptC (LptBFGC), trapped in either the LPS- or AMP-PNP-bound state. The structures reveal conformational changes between these states and substrate binding with or without LptC. We identify two functional transmembrane arginine-containing loops interacting with the bound AMP-PNP and elucidate allosteric communications between the domains. AMP-PNP binding induces an inward rotation and shift of the transmembrane helices of LptFG and LptC to tighten the cavity, with the closure of two lateral gates, to eventually expel LPS into the bridge. Functional assays reveal the functionality of the LptF and LptG periplasmic domains. Our findings shed light on the LPS transport mechanism. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10121.map.gz emd_10121.map.gz | 20.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10121-v30.xml emd-10121-v30.xml emd-10121.xml emd-10121.xml | 16 KB 16 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_10121.png emd_10121.png | 54.3 KB | ||
| Filedesc metadata |  emd-10121.cif.gz emd-10121.cif.gz | 6.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10121 http://ftp.pdbj.org/pub/emdb/structures/EMD-10121 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10121 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10121 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10121_validation.pdf.gz emd_10121_validation.pdf.gz | 514.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10121_full_validation.pdf.gz emd_10121_full_validation.pdf.gz | 513.8 KB | 表示 | |
| XML形式データ |  emd_10121_validation.xml.gz emd_10121_validation.xml.gz | 5.6 KB | 表示 | |
| CIF形式データ |  emd_10121_validation.cif.gz emd_10121_validation.cif.gz | 6.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10121 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10121 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10121 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10121 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10121.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10121.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | None | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.014 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : LptB2FGC
| 全体 | 名称: LptB2FGC |
|---|---|
| 要素 |
|
-超分子 #1: LptB2FGC
| 超分子 | 名称: LptB2FGC / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 / 詳細: LPS transporter LptB2FGC |
|---|---|
| 由来(天然) | 生物種:  Shigella flexneri (フレクスナー赤痢菌) Shigella flexneri (フレクスナー赤痢菌) |
-分子 #1: Lipopolysaccharide ABC transporter, ATP-binding protein LptB
| 分子 | 名称: Lipopolysaccharide ABC transporter, ATP-binding protein LptB タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Shigella flexneri (フレクスナー赤痢菌) Shigella flexneri (フレクスナー赤痢菌) |
| 分子量 | 理論値: 26.837668 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MATLTAKNLA KAYKGRRVVE DVSLTVNSGE IVGLLGPNGA GKTTTFYMVV GIVPRDAGNI IIDDDDISLL PLHARARRGI GYLPQEASI FRRLSVYDNL MAVLQIRDDL SAEQREDRAN ELMEEFHIEH LRDSMGQSLS GGERRRVEIA RALAANPKFI L LDEPFAGV ...文字列: MATLTAKNLA KAYKGRRVVE DVSLTVNSGE IVGLLGPNGA GKTTTFYMVV GIVPRDAGNI IIDDDDISLL PLHARARRGI GYLPQEASI FRRLSVYDNL MAVLQIRDDL SAEQREDRAN ELMEEFHIEH LRDSMGQSLS GGERRRVEIA RALAANPKFI L LDEPFAGV DPISVIDIKR IIEHLRDSGL GVLITDHNVR ETLAVCERAY IVSQGHLIAH GTPTEILQDE HVKRVYLGED FR L UniProtKB: Lipopolysaccharide export system ATP-binding protein LptB |
-分子 #2: LPS export ABC transporter permease LptF
| 分子 | 名称: LPS export ABC transporter permease LptF / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Shigella flexneri (フレクスナー赤痢菌) Shigella flexneri (フレクスナー赤痢菌) |
| 分子量 | 理論値: 40.45352 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MIIIRYLVRE TLKSQLAILF ILLLIFFCQK LVRILGAAVD GDIPANLVLS LLGLGVPEMA QLILPLSLFL GLLMTLGKLY TESEITVMH ACGLSKAVLV KAAMILAVFT AIVAAVNVMW AGPWSSRHQD EVLEEAKANP GMAALAQGQF QQATNGSSVL F IESVDGSD ...文字列: MIIIRYLVRE TLKSQLAILF ILLLIFFCQK LVRILGAAVD GDIPANLVLS LLGLGVPEMA QLILPLSLFL GLLMTLGKLY TESEITVMH ACGLSKAVLV KAAMILAVFT AIVAAVNVMW AGPWSSRHQD EVLEEAKANP GMAALAQGQF QQATNGSSVL F IESVDGSD FKDVFLAQIR PKGNARPSVV VADSGHLTQL RDGSQVVTLN QGTRFEGTAL LRDFRITDFQ DYQAIIGHQA VA LDPNDTD QMDMRTLWNT DTDRARAELN WRITLVVTVF MMALMVVPLS VVNPRQGRVL SMLPAMLLYL LFFLIQTSLK SNG GKGKLD PTLWMWTVNL IYLALAIVLN LWDTVFVRRL RASFSRKGAV UniProtKB: Lipopolysaccharide export system permease protein LptF |
-分子 #3: Inner membrane protein yjgQ
| 分子 | 名称: Inner membrane protein yjgQ / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Shigella flexneri (フレクスナー赤痢菌) Shigella flexneri (フレクスナー赤痢菌) |
| 分子量 | 理論値: 39.622414 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MQPFGVLDRY IGKTIFTTIM MTLFMLVSLS GIIKFVDQLK KAGQGSYDAL GAGMYTLLSV PKDVQIFFPM AALLGALLGL GMLAQRSEL VVMQASGFTR MQVALSVMKT AIPLVLLTMA IGEWVAPQGE QMARNYRAQA MYGGSLLSTQ QGLWAKDGNN F VYIERVKG ...文字列: MQPFGVLDRY IGKTIFTTIM MTLFMLVSLS GIIKFVDQLK KAGQGSYDAL GAGMYTLLSV PKDVQIFFPM AALLGALLGL GMLAQRSEL VVMQASGFTR MQVALSVMKT AIPLVLLTMA IGEWVAPQGE QMARNYRAQA MYGGSLLSTQ QGLWAKDGNN F VYIERVKG DEVLGGISIY AFNENRRLQS VRYAATAKFD PEHKVWRLSQ VDESDLTNPK QITGSQTVSG TWKTDLTPDK LG VVALDPD ALSISGLHNY VKYLKSSGQD AGRYQLNMWS KIFQPLSVAV MMLMALSFIF GPLRSVPMGV RVVTGISFGF VFY VLDQIF GPLTLVYGIP PIIGALLPSA SFFLISLWLL MRKS UniProtKB: Inner membrane protein yjgQ |
-分子 #4: PHOSPHOAMINOPHOSPHONIC ACID-ADENYLATE ESTER
| 分子 | 名称: PHOSPHOAMINOPHOSPHONIC ACID-ADENYLATE ESTER / タイプ: ligand / ID: 4 / コピー数: 2 / 式: ANP |
|---|---|
| 分子量 | 理論値: 506.196 Da |
| Chemical component information |  ChemComp-ANP: |
-分子 #5: tetradecyl 4-O-alpha-D-glucopyranosyl-beta-D-glucopyranoside
| 分子 | 名称: tetradecyl 4-O-alpha-D-glucopyranosyl-beta-D-glucopyranoside タイプ: ligand / ID: 5 / コピー数: 1 / 式: LMD |
|---|---|
| 分子量 | 理論値: 538.669 Da |
| Chemical component information | 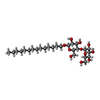 ChemComp-LMD: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1 mg/mL | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.8 / 構成要素:
| ||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 298 K / 装置: FEI VITROBOT MARK III |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: DIFFRACTION |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 3.5 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 3) / 使用した粒子像数: 149178 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
 ムービー
ムービー コントローラー
コントローラー






















