+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-1009 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | A cryo-electron microscopic study of ribosome-bound termination factor RF2. | |||||||||
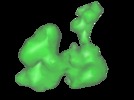
 マップデータ マップデータ | The RF2(GAQ) mutant cryo-density from the 3D-EM map of RF2 mutant bound to the E.coli 70s ribosome | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報translation release factor activity, codon specific / translational termination / small ribosomal subunit / large ribosomal subunit rRNA binding / cytosolic large ribosomal subunit / tRNA binding / rRNA binding / structural constituent of ribosome / translation / viral translational frameshifting / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 10.9 Å | |||||||||
 データ登録者 データ登録者 | Rawat UB / Zavialov AV / Sengupta J / Valle M / Grassucci RA / Linde J / Vestergaard B / Ehrenberg M / Frank J | |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2003 ジャーナル: Nature / 年: 2003タイトル: A cryo-electron microscopic study of ribosome-bound termination factor RF2. 著者: Urmila B S Rawat / Andrey V Zavialov / Jayati Sengupta / Mikel Valle / Robert A Grassucci / Jamie Linde / Bente Vestergaard / Måns Ehrenberg / Joachim Frank /  要旨: Protein synthesis takes place on the ribosome, where genetic information carried by messenger RNA is translated into a sequence of amino acids. This process is terminated when a stop codon moves into ...Protein synthesis takes place on the ribosome, where genetic information carried by messenger RNA is translated into a sequence of amino acids. This process is terminated when a stop codon moves into the ribosomal decoding centre (DC) and is recognized by a class-1 release factor (RF). RFs have a conserved GGQ amino-acid motif, which is crucial for peptide release and is believed to interact directly with the peptidyl-transferase centre (PTC) of the 50S ribosomal subunit. Another conserved motif of RFs (SPF in RF2) has been proposed to interact directly with stop codons in the DC of the 30S subunit. The distance between the DC and PTC is approximately 73 A. However, in the X-ray structure of RF2, SPF and GGQ are only 23 A apart, indicating that they cannot be at DC and PTC simultaneously. Here we show that RF2 is in an open conformation when bound to the ribosome, allowing GGQ to reach the PTC while still allowing SPF-stop-codon interaction. The results indicate new interpretations of accuracy in termination, and have implications for how the presence of a stop codon in the DC is signalled to PTC. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_1009.map.gz emd_1009.map.gz | 7.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-1009-v30.xml emd-1009-v30.xml emd-1009.xml emd-1009.xml | 8.8 KB 8.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  1009.gif 1009.gif | 15.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-1009 http://ftp.pdbj.org/pub/emdb/structures/EMD-1009 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1009 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1009 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_1009_validation.pdf.gz emd_1009_validation.pdf.gz | 278 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_1009_full_validation.pdf.gz emd_1009_full_validation.pdf.gz | 277.6 KB | 表示 | |
| XML形式データ |  emd_1009_validation.xml.gz emd_1009_validation.xml.gz | 5.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1009 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1009 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1009 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1009 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_1009.map.gz / 形式: CCP4 / 大きさ: 8.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_1009.map.gz / 形式: CCP4 / 大きさ: 8.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | The RF2(GAQ) mutant cryo-density from the 3D-EM map of RF2 mutant bound to the E.coli 70s ribosome | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.82 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : RF2 (GAQ) mutant from E.coli
| 全体 | 名称: RF2 (GAQ) mutant from E.coli |
|---|---|
| 要素 |
|
-超分子 #1000: RF2 (GAQ) mutant from E.coli
| 超分子 | 名称: RF2 (GAQ) mutant from E.coli / タイプ: sample / ID: 1000 詳細: SPIDER was used for the computational isolation of the RF2(GAQ) mutant cryo-density from the 3D-EM map of RF2 mutant bound to the E.coli 70s ribosome (EMD-1008). Number unique components: 1 |
|---|
-分子 #1: RF2 (GAQ) mutant
| 分子 | 名称: RF2 (GAQ) mutant / タイプ: protein_or_peptide / ID: 1 / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 凍結 | 凍結剤: ETHANE |
|---|
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| 温度 | 平均: 93 K |
| 詳細 | information is the same as in submission EMD-1008 |
| 日付 | 2001年8月2日 |
| 撮影 | カテゴリ: FILM / フィルム・検出器のモデル: KODAK SO-163 FILM / デジタル化 - スキャナー: ZEISS SCAI / 平均電子線量: 20 e/Å2 / 詳細: entry EMD-1008 |
| Tilt angle min | 0 |
| Tilt angle max | 0 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 49696 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 最大 デフォーカス(公称値): 4.05 µm / 最小 デフォーカス(公称値): 2.25 µm / 倍率(公称値): 50000 |
| 試料ステージ | 試料ホルダー: Oxford, cryo-transfer 3500 / 試料ホルダーモデル: GATAN LIQUID NITROGEN |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
- 画像解析
画像解析
| 詳細 | entry EMD-1008 |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 10.9 Å 詳細: information is the same as in submission 1186. SPIDER was used for the computational isolation of the RF2 (GAQ) mutant cryo-density from the 3D-EM map of RF2 mutant bound to the E.coli 70s ribosome (EMD-1008). 使用した粒子像数: 1 |
-原子モデル構築 1
| 初期モデル | (PDB ID: , ) |
|---|---|
| 得られたモデル |  PDB-1mi6:  PDB-1mvr: |
 ムービー
ムービー コントローラー
コントローラー






















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






















